蛋殼中含有碳酸鈣,興趣小組的同學對蛋殼進行如下探究:
(1)證明蛋殼中含有碳酸根,其方法是______;
(2)用鑷子取一片蛋殼在酒精燈外焰上加熱,蛋殼變為白色,該過程中發生反應的化學方程式為______ CaO+CO2↑
【答案】
分析:(1)驗證物質含有碳酸根,需要將之轉化為二氧化碳后檢驗二氧化碳,所以需要用到鹽酸和石灰水具體才做可以個性化.
(2)碳酸鈣在高溫時能夠分解為氧化鈣和二氧化碳,而氧化鈣在水中能夠生成氫氧化鈣,顯堿性.
(3)計算蛋殼中的碳酸鈣的質量分數,指需要根據二氧化碳的生成量求算出碳酸鈣的質量,進而求算其質量分數.
解答:解:(1)驗證蛋殼含有碳酸根,由于不可溶,所以無法借助生成碳酸鈣的現象確定,需要將之轉化為二氧化碳,之后再用石灰水確定二氧化碳的存在.故答案為:將粉碎后的蛋殼中加到盛有稀鹽酸的燒杯中,再將涂有澄清石灰水的玻璃片罩在燒杯上,觀察石灰水是否變渾濁.變渾濁則原物質一定含有碳酸根,否則就不含.(其他方法,合理也可).
(2)碳酸鈣在高溫時分解為氧化鈣和二氧化碳,而氧化鈣遇到水能夠生成堿性的氫氧化鈣,而堿性的氫氧化鈣能使酚酞變成紅色.
故答案為:CaCO
3
CaO+CO
2↑;紅;CaO+H
2O=Ca(OH)
2.
(3)設3.2g蛋殼中含有的碳酸鈣的質量為x.
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
100 44
x 0.88g
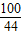
=
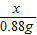
x=2g.
則蛋殼中碳酸鈣的質量分數為
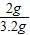
×100%=62.5%
答:蛋殼中碳酸鈣的質量分數為62.5%
點評:進行計算時含有雜質的數值不能用于方程式的計算.而驗證物質含有碳酸根時,原理是先轉化后檢驗,而具體的操作多樣化.

 CaO+CO2↑;紅;CaO+H2O=Ca(OH)2.
CaO+CO2↑;紅;CaO+H2O=Ca(OH)2.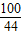 =
=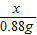
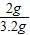 ×100%=62.5%
×100%=62.5%
