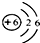解:(1)碳屬于非金屬元素,原子序數是6,等于核內質子數也是6,正下方是相對原子質量,相對原子質量單位是1省略不寫,不是g故答案D不對,所以選D答案;
(2)①反應物是固體和液體不需要加熱,由于二氧化碳能溶于水,不能用排水法收集,密度比空氣大只能用向上排空氣法收集;
②由于反應條件是加熱,用到酒精燈,所以發生裝置是A,第二種方法的生成物中有兩種氣體,制得的氣體不純;
③藥品中含有潮氣加熱后變為水蒸氣,如果試管口向上傾斜,水蒸氣在試管口會冷凝成水滴倒流入試管底部,使試管炸裂;
(3)①往第二朵紙花上噴上水,紙花不變色證明水不能使紫色石蕊試液變紅;
②通過設計的對比實驗可知缺少證明二氧化碳是否能使紫色石蕊試液變色;
③反應物是二氧化碳和水,生成物是碳酸,已經平了;
(4)根據藥品質量的減少量是生成二氧化碳的質量,所以生成二氧化碳:12.5g+50g-58.1g=4.4g,設要生成4.4g二氧化碳需碳酸鈣質量為X則:
CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑
100 44
X 4.4g
根據:
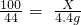
解得X=10g,所以含雜質12.5g-10g=2.5g,所以雜質質量分數:
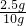
×100%=25%.
故答案為:(1)D;(2)①B;C;②A;生成的二氧化碳中混有氨氣③防止水蒸氣倒流入試管內使試管炸裂(3)①證明水不能使紫色石蕊試液變紅;②將第二朵紙花伸入盛有二氧化碳的集氣瓶中③CO
2+H
2O=H
2CO
3;(4)25%
分析:(1)根據元素周期表表示的意義考慮;(2)①根據氣體發生裝置和收集裝置的選取方法考慮;②根據反應條件和生成物考慮;③根據藥品中含有潮氣導致的后果考慮;(3)①根據實驗現象考慮證明的問題;②通過對比試驗缺少的方面考慮③根據方程式的寫法考慮;(4)根據藥品質量的減少量是生成二氧化碳的質量,再根據二氧化碳的質量算出碳酸鈣的質量,再用混合物質量減去碳酸鈣的質量就是雜質質量.
點評:通過回答本題要知道反應物的狀態是固體和液體,不需要加熱,如果固體與固體反應制取氣體需要加熱,收集方法的選擇是根據:難溶于水或不易溶于水用排水法收集,密度比空氣大用向上排空氣法收集,密度比空氣小用向下排空氣法收集;制取二氧化碳用鹽酸和碳酸鈣是固體和液體不需要加熱,反應裝置選B,由于二氧化碳密度比空氣大,用向上排空氣法收集,能溶于水不能用排水法收集.知道了對比試驗的設計方法,根據現象說出結論方法.

 碳是形成化合物種類最多的元素,含碳物質是中學化學研究的重要內容.
碳是形成化合物種類最多的元素,含碳物質是中學化學研究的重要內容.

 Na2CO3+H2O+CO2↑ NH4HCO3
Na2CO3+H2O+CO2↑ NH4HCO3 NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑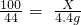 解得X=10g,所以含雜質12.5g-10g=2.5g,所以雜質質量分數:
解得X=10g,所以含雜質12.5g-10g=2.5g,所以雜質質量分數: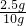 ×100%=25%.
×100%=25%.

 黃岡冠軍課課練系列答案
黃岡冠軍課課練系列答案 碳是形成化合物種類最多的元素,含碳物質是中學化學研究的重要內容.
碳是形成化合物種類最多的元素,含碳物質是中學化學研究的重要內容. 碳是形成化合物種類最多的元素,含碳物質是中學化學研究的重要內容.
碳是形成化合物種類最多的元素,含碳物質是中學化學研究的重要內容.
 碳是形成化合物種類最多的元素,含碳物質是中學化學研究的重要內容.
碳是形成化合物種類最多的元素,含碳物質是中學化學研究的重要內容. D.碳的相對原子質量為12.01
D.碳的相對原子質量為12.01
 碳是形成化合物種類最多的元素,含碳物質是中學化學研究的重要內容.
碳是形成化合物種類最多的元素,含碳物質是中學化學研究的重要內容.