
【題目】我國科學家建立國家尺度的氮足跡混合分析方法,來評價生命周期的氮流動。如圖是氮元素在元素周期表的信息,下列判斷不正確的是( )
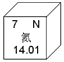
A.氮元素屬于非金屬元素
B.氮原子核外有2個電子層
C.氮的相對原子質量為14.01
D.化學反應中,氮原子易失去電子
 口算能手系列答案
口算能手系列答案科目:初中化學 來源: 題型:
【題目】(1)請根據下列實驗和溶解度曲線回答問題(已知水的密度約為1 g/cm3)
實驗操作 | 實驗結果 |
|
取100 mL水,加入25 g硝酸鉀,攪拌恢復至20℃ | 全部溶解,得溶液A | |
再加w g硝酸鉀,攪拌,恢復到20℃ | 恰好飽和,得溶液B | |
再加25 g硝酸鉀,攪拌,恢復到20℃ | 得溶液C | |
加熱 | 全部溶解,得溶液D | |
冷卻至20℃ | 析出晶體,得溶液E |
①表中w的值為__________。
②一定屬于不飽和溶液的是______(填序號)。
③溶質的質量分數一定相等的溶液是B和___(填序號),此時溶質的質量分數是___(精確到0.01%)。
(2)許多果農用鉬素去促進東魁楊梅優質豐產;金屬元素鉬(Mo)通常用作合金及不銹鋼的添加劑。化工生產中制備金屬鉬的主要流程如下圖:
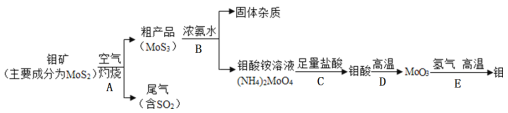
①步驟A中,灼燒鉬礦通常會將礦石粉碎成小顆粒,其目的是__________________。
②現有:a燒杯b玻璃棒c漏斗d酒精燈等四種儀器,如果在實驗室模擬步驟B,則不需要選用的是_____(填字母序號)。
③寫出步驟E的化學方程式______________________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】工業上以硫鐵礦為原料生產硫酸,有關工業流程圖如下:
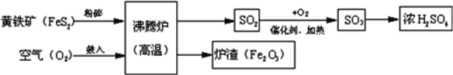
(1)硫鐵礦的主要成分是FeS2,名稱為二硫化亞鐵,其中的硫元素化合價應為______。在加入沸騰爐之前,粉碎硫鐵礦,是為了_______________________。
(2)該流程中涉及的空氣污染氣體是二氧化硫,形成的危害是_______。寫出流程中SO2轉化為SO3的化學方程式為_________________________________。
(3)實驗室里將100g溶質質量分數為98%的濃硫酸稀釋為10%的硫酸,需要水____g。需要的玻璃儀器有膠頭滴管、玻璃棒、_______和______,此處玻璃棒的作用是_______。
(4)用稀硫酸可除去鐵制品表面的鐵銹,化學方程式為_____________________,硫酸在現代工業上還有哪些用途(只寫一點即可)________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】實驗室制取氣體的裝置如圖所示,根據所學的知識回答下列問題。
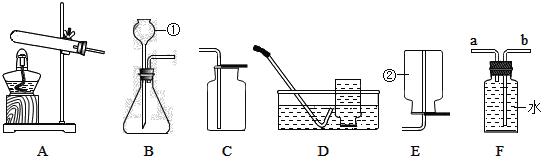
(1)圖中標有①、②的儀器名稱:①________;②________。
(2)寫出用裝置B和C制取氧氣的化學方程式__________,驗滿的方法是_________。
(3)用C裝置收集的原因是___________,若用D裝置收集氧氣,操作時的正確順序為:_____→_____→_____(填編號)。
①將導管深入集氣瓶口,氣體進入瓶中
②將裝滿水的集氣瓶倒置在水槽中
③當氣體收集滿時,用毛玻璃片蓋上瓶口,將集氣瓶移出水面放置
(4)B裝置要通過控制滴加液體的速度,來控制反應速率,應將長頸漏斗改為_____(填儀器名稱)。F裝置中充滿水時,可作為氧氣的收集裝置,則氧氣應從____端通入(填“a”或“b”)。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某化學反應的微觀過程如圖,則下列說法中,不合理的是( )
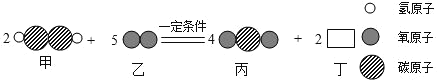
A.該反應屬于置換反應B.生成物丙和丁均為氧化物
C.物質丁的化學式是H2OD.反應前后原子的種類、數目沒有改變
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】我國食鹽價格放開,促進鹽業改革。食鹽氯化鈉食鹽是日常生活的必需品,圖一是家用環保型消毒液發生器示意圖,圖二是發生反應原理的流程圖。

(1)實驗室里做溶解實驗時,要用玻璃棒不斷攪拌,其目的是_______________。
(2)根據圖二中的反應原理,電解氯化鈉稀溶液的化學方程式為_______________,從能量變化角度看,該反應將___能轉化為化學能。
(3)電解含氯化鈉2.34 g的飽和食鹽水,則可制得氫氣的質量是多少______?
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】小明將未打磨的鋁片和稀鹽酸放入密閉容器中,用傳感器探究反應過程中溫度和壓強的變化,如右圖所示。從圖中所獲信息不正確的是


A. 反應過程中有熱量放出B. 50s時,溶液中溶質為AlCl3
C. 0~50s,發生Al2O3+6HCl===2AlCl3+3H2O反應D. 100—140s,壓強減小是因為溫度降低
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】高純氧化鐵(Fe2O3)又稱“引火鐵”,可作催化劑,在現代工業上有廣泛應用前景。以下是用赤鐵礦(含少量 SiO2 等雜質)為原料,制備高純氧化鐵的生產流程示意圖。
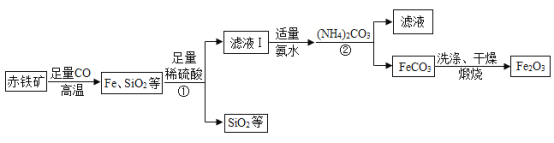
已知:氨水呈堿性(主要成分NH3·H2O是一種堿);(NH4)2CO3溶液呈堿性,40℃以上易分解。
(1)寫出高溫時赤鐵礦中的Fe2O3 與 CO 發生反應的化學方程式_____。
(2)①和②處的操作是_____,這個操作中玻璃棒的作用是_____。
(3)加入(NH4)2CO3 后,該反應必須控制的條件是_____;(NH4)2CO3與FeSO4 發生復分解反應而生成FeCO3,則②處反應的化學方程式為_____。
(4)用蒸餾水洗滌FeCO3 的目的是除去表面附著的雜質,洗滌干凈的標志是:取最后一次洗滌液,向其中加入適量的 BaCl2 溶液,無_____(填現象)產生,即為洗滌干凈。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com