
造成酸雨的主要物質是二氧化硫(SO2),某興趣小組的同學收集某地剛降到地面的雨水進行實驗.
相關信息:①用pH計(測pH的儀器)每隔幾分鐘測一次pH,其數據如下表所示:
③BaSO3不溶于水,但能跟稀鹽酸反應,BaSO4既不溶于水,也不與稀鹽酸反應
分析討論:①酸雨能使土壤酸化,農業上常用________中和酸性土壤.
②酸雨能腐蝕金屬制品,請寫出一種防止室外金屬被腐蝕的方法________.
③收集的酸雨樣品放置一段時間后pH減小,原因是SO2與H2O反應生成H2SO3被氧化為H2SO4,請寫出H2SO3被氧化生成H2SO4的化學方程式________.
提出猜想:同學們對收集到的酸雨樣品的溶質進行猜想:
猜想Ⅰ:酸雨中溶質為H2SO3
猜想Ⅱ:酸雨中溶質為H2SO4
猜想Ⅲ:酸雨中溶質為________
實驗探究:向收集的酸雨樣品中滴加過量的Ba(OH)2溶液,有白色沉淀生成,過濾,向沉淀中加入足量的稀鹽酸,請完成下表:
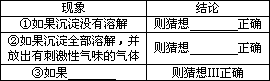
④請寫出加入稀鹽酸后沉淀溶解并放出有刺激性氣味氣體的化學方程式________.
拓展延伸:酸雨中含有的酸除了上面的H2SO3和H2SO4以及空氣中CO2與H2O反應生成的H2CO3外,還可能含有的酸根是________.
|
答案:分析討論:①氫氧化鈣; ②涂油漆(涂油、保持金屬表面干燥等); ③2H2SO3+O2=2H2SO4; 提出猜想:既有H2SO3又有H2SO4;Ⅰ;Ⅱ;沉淀部分溶解且放出有刺激性氣味氣體;BaSO3+2HCl=BaCl2+SO2↑+H2O; 拓展延伸:NO 分析:分析討論:①依據農業上治理酸化土壤的方法分析解決. ②依據金屬生銹的條件選擇防止金屬生銹的方法即可. ③依據SO2與H2O反應生成H2SO3被氧化為H2SO4的敘述書寫有關的方程式即可; 提出猜想:綜合猜想Ⅰ、Ⅱ兩種情況分析即可; 從反應的現象推斷猜想的合理性,利用硫酸鋇不溶于酸,以及亞硫酸鋇能與鹽酸反應對問題進行分析; 拓展延伸:依據形成酸雨的氣體主要是二氧化硫及二氧化氮對酸雨中的酸根情況進行分析即可; 解答:解:分析討論①農業上治理酸化土壤的方法是采用氫氧化鈣與土壤中的酸發生中和反應,從而降低酸性; ②金屬生銹的條件是水與氧氣共存,所以防止金屬生銹的方法即是控制生銹的條件,常用的方法有涂油漆、涂油、保持金屬表面干燥等; ③H2SO3被氧化為H2SO4的方程式為:2H2SO3+O2=2H2SO4; 提出猜想:綜合猜想Ⅰ、Ⅱ兩種情況分析可知猜想Ⅲ應該是兩者都有; 從反應的現象推斷猜想的合理性,①如果沉淀沒有溶解,因為硫酸鋇不溶于酸,所以可判斷溶液中只含有硫酸; ②如果沉淀全部溶解,并放出有刺激性氣味的氣體,說明溶液中不含有硫酸,只含有亞硫酸; ③從何①②可知猜想III成立則應該是既有不溶的沉淀又有可溶的沉淀,且溶解時放出有刺激性氣味的氣體; ④依據稀鹽酸加入后沉淀溶解并放出有刺激性氣味氣體,可知該反應是亞硫酸鋇和鹽酸,生成物是氯化鋇、二氧化硫和水,其方程式為:BaSO3+2HCl=BaCl2+SO2↑+H2O; 拓展延伸:因為形成酸雨的氣體主要是二氧化硫及二氧化氮所以酸雨中除去含有以上酸根外,還可能含有硝酸根; 點評:此題是一道探究酸雨的成分實驗題,依據題目中的相關信息,結合所學的有關知識對物質的驗證和判斷進行相關的處理是解題的關鍵. |
|
酸雨的產生、危害及防治;實驗探究物質的組成成分以及含量;酸的化學性質;中和反應及其應用;書寫化學方程式、文字表達式、電離方程式. |


 中考解讀考點精練系列答案
中考解讀考點精練系列答案科目:初中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com