某校研究性學習小組為確定實驗室中一瓶久置氫氧化鈉的變質程度做了如下實驗:
稱取21.2g氫氧化鈉樣品于燒杯中,注入50g水配成溶液,然后加入75g足量的稀硫酸,完全反應后測得燒杯中溶液質量為144g.
請計算:該樣品中氫氧化鈉的質量分數為多少?
【反思與交流】根據化學方程式分析:沒有變質的氫氧化鈉與ag稀硫酸恰好完全反應,部分變質后與bg相同稀硫酸恰好完全反應,則a________b(填“>”、“=”或“<”).
=
分析:氫氧化鈉吸收二氧化碳后生成碳酸鈉,碳酸鈉與稀硫酸反應可生成硫酸鈉、水和二氧化碳,而氫氧化鈉雖可與稀硫酸反應但卻不放出氣體;因此,反應后所剩余溶液的質量小于反應前各物質的質量和,反應前后的質量差即為放出的二氧化碳氣體的質量;根據碳酸鈉與硫酸反應的化學方程式,利用反應放出的二氧化碳的質量可計算參加反應的碳酸鈉的質量;樣品質量與碳酸鈉的質量差即為未變質的氫氧化鈉的質量,所計算的氫氧化鈉質量與樣品質量比即樣品中氫氧化鈉的質量分數
分析反應的化學方程式,①CO
2+2NaOH=Na
2CO
3+H
2O,②Na
2CO
3+H
2SO
4=Na
2SO
4+H
2O+CO
2↑,綜合①②,可得:2NaOH+H
2SO
4=Na
2SO
4+2H
2O,所以NaOH部分變質或全部變質,與沒有變質的NaOH相比,中和反應時消耗稀硫酸的量相等.
解答:反應生成CO
2的質量:(21.2g+50g+75g)-144g=2.2g
設樣品中碳酸鈉的質量為x,
Na
2CO
3+H
2SO
4═Na
2 SO
4+H
2O+CO
2↑
106 44
x 2.2g

=
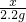
解得x=5.3g
樣品中氫氧化鈉的質量分數:
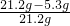
×100%=75%
【反思與交流】分析反應的化學方程式,①CO
2+2NaOH=Na
2CO
3+H
2O,②Na
2CO
3+H
2SO
4=Na
2SO
4+H
2O+CO
2↑,綜合①②,可得:2NaOH+H
2SO
4=Na
2SO
4+2H
2O,所以NaOH部分變質或全部變質,與沒有變質的NaOH相比,中和反應時消耗稀硫酸的量相等,故本題答案為:=.
點評:利用質量守恒定律,根據反應前后小燒杯內物質的質量差,可得完全反應放出二氧化碳氣體的質量;然后利用二氧化碳的質量,結合反應的化學方程式,可計算參加反應的碳酸鈉的質量.

 =
=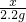
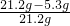 ×100%=75%
×100%=75%

 教育世家狀元卷系列答案
教育世家狀元卷系列答案 黃岡課堂作業本系列答案
黃岡課堂作業本系列答案 單元加期末復習先鋒大考卷系列答案
單元加期末復習先鋒大考卷系列答案 某校研究性學習小組用如圖裝置進行鎂條在空氣中燃燒的實驗.先將鎂條燃燒、冷卻后打開止水夾,進入集氣瓶中水的體積約占集氣瓶體積的70%.
某校研究性學習小組用如圖裝置進行鎂條在空氣中燃燒的實驗.先將鎂條燃燒、冷卻后打開止水夾,進入集氣瓶中水的體積約占集氣瓶體積的70%.