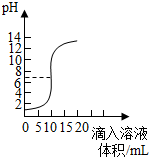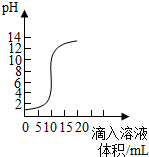
(2013?閔行區二模)如圖是氫氧化鈣溶液和鹽酸用滴加方式反應時溶液pH隨滴入溶液體積變化曲線.
(1)該反應的化學方程式為
Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+2HCl=CaCl2+2H2O
;在圖中曲線上標出氫氧化鈣和鹽酸恰好完全反應的點.
(2)根據曲線判斷,該反應是將
氫氧化鈣溶液;
氫氧化鈣溶液;
(填“氫氧化鈣溶液”或“鹽酸”)滴入另一溶液中,理由是
開始溶液pH<7呈酸性
開始溶液pH<7呈酸性
.
(3)當滴入溶液的體積為5mL時,所得溶液中的溶質為
HCl和CaCl2
HCl和CaCl2
(寫化學式),
此時將燒杯內溶液如果未經處理直接倒入鐵制下水道,你認為可能造成的危害是(用化學方程式表示)
Fe+2HCl=FeCl2+H2↑
Fe+2HCl=FeCl2+H2↑
.要想處理燒杯內溶液使其只得到CaCl
2溶液,應向溶液中加入過量
CaCO3
CaCO3
,充分反應后過濾.

 (2013?閔行區二模)如圖是氫氧化鈣溶液和鹽酸用滴加方式反應時溶液pH隨滴入溶液體積變化曲線.
(2013?閔行區二模)如圖是氫氧化鈣溶液和鹽酸用滴加方式反應時溶液pH隨滴入溶液體積變化曲線.