
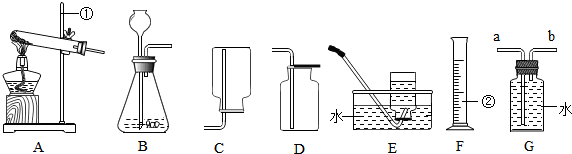
 桐桐采集了一塊石灰石樣品,該樣品雜質只含二氧化硅(二氧化硅是一種既不溶于水也不與鹽酸反應且耐高溫的固體).
桐桐采集了一塊石灰石樣品,該樣品雜質只含二氧化硅(二氧化硅是一種既不溶于水也不與鹽酸反應且耐高溫的固體).分析 (1)在常溫下,用碳酸鈣和鹽酸互相交換成分生成氯化鈣和水和二氧化碳,因此不需要加熱.
(2)根據質量守恒定律分析樣品質量,根據反應時間曲線可查出碳酸鈣完全反應后放出氣體二氧化碳的質量,利用生成二氧化碳的質量計算出所取樣品中碳酸鈣質量,碳酸鈣質量與樣品質量比即樣品中碳酸的質量分數.
解答 解:(1)在常溫下,用碳酸鈣和鹽酸互相交換成分生成氯化鈣和水和二氧化碳,因此不需要加熱,故選B裝置.故填B;
(2)樣品質量為76g-20g-50g=6g;故答案為:6;
①為避免樣品中碳酸鈣不能完成反應,可把樣品粉碎,增大樣品與鹽酸的接觸面積,此舉還可以加快反應的速率;
故答案為:增大石灰石與鹽酸的接觸面積使碳酸鈣更充分反應;加快反應速率.
②圖中質量軸上每個小刻度表示0.2g,所以完全放出氣體后剩余物質總質量為73.8g;
根據質量守恒定律,因此放出氣體二氧化碳的質量=76g-73.8g=2.2g
故答案為:2.2g;
③設石灰石樣品中碳酸鈣的質量為x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2g
$\frac{100}{x}$=$\frac{44}{2.2g}$
解之得 x=5g
石灰石樣品中碳酸鈣的質量分數=$\frac{5g}{6g}$×100%=83.3%.
答:該石灰石樣品中碳酸鈣的質量分數是83.3%.
點評 準確判斷圖中刻度值是正確解決本題一個重要細節,是正確判斷生成二氧化碳質量的關鍵.


科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | ① | B. | ② | C. | ③ | D. | 全都可以 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
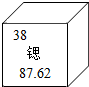 美國物理學家研制出迄今最精確的“鍶晶格原子鐘”,運行50億年也不會偏差1秒.根據如圖,下列說法正確的是( )
美國物理學家研制出迄今最精確的“鍶晶格原子鐘”,運行50億年也不會偏差1秒.根據如圖,下列說法正確的是( )| A. | 鍶原子的中子數是38 | |
| B. | 鍶的元素符號為SR | |
| C. | 鍶元素原子的相對原子質量為87.62g | |
| D. | 鍶這種物質由原子構成 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
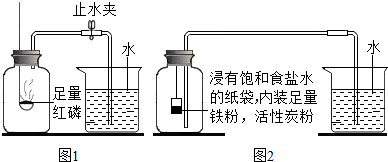
| 測量項目 | 實驗前 | 實驗后 | |
| 燒杯中水的體積 | 燒杯中剩余水的體積 | 集氣瓶(扣除內容物)和導管的容積 | |
| 體積/mL | 80.0 | 54.5 | 126.0 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
| 實驗序號 | 實驗1 | 實驗2 | 實驗3 |
| 實驗操作 |  |  | 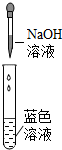 |
| 實驗現象 | 鐵絲表面出現紅色物質 | 產生白色沉淀,甲稀NHO3后沉淀不溶解 | 產生藍色絮狀沉淀 |
| 實驗結論 | 可能含有Cu元素 | (1)白色沉淀是硫酸鋇 | (2)“藍色水”中含有溶質的化學式是CuSO4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com