
 《化學與生活》告訴我們,鈣對維持人體的循環、呼吸、肌肉、骨骼及免疫等系統正常生理功能具有重要作用.如圖是“鈣片商品標簽圖”
《化學與生活》告訴我們,鈣對維持人體的循環、呼吸、肌肉、骨骼及免疫等系統正常生理功能具有重要作用.如圖是“鈣片商品標簽圖”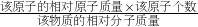 ×100%,所以碳酸鈣中鈣元素的質量分數為:
×100%,所以碳酸鈣中鈣元素的質量分數為: ×100%=40%;
×100%=40%;

 名校課堂系列答案
名校課堂系列答案科目:初中化學 來源:同步題 題型:填空題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com