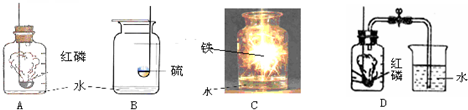
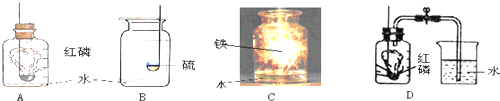
解:(1)在裝置B中,若用高錳酸鉀制氧氣,為防止叫熱過程中高錳酸鉀進入導氣管,試管口應放一團棉花;若用氯酸鉀和二氧化錳制氧氣,其中的反應物是氯酸鉀,反應條件是加熱,二氧化錳做催化劑,生成物是氯化鉀和氧氣,反應方程式是:2KClO
3 
2KCl+3O
2↑.
故答案為:一團棉花; 防止高錳酸鉀進入導氣管;2KClO
3 
2KCl+3O
2↑.
(2)根據過氧化鈉在常溫下可與水反應生成氫氧化鈉和氧氣,可知化學方程式是:2Na
2O
2+2H
2O═4NaOH+O
2↑.
故答案為:2Na
2O
2+2H
2O═4NaOH+O
2↑.
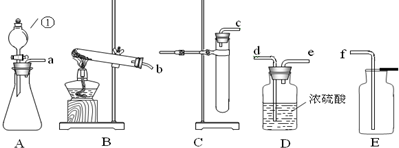
(3)如果在實驗室中用A裝置作氣體發生裝置,用過氧化鈉和水反應來制取一瓶干燥的氧氣,需要用濃硫酸干燥后收集,用濃硫酸干燥時為充分吸收水分,要使氣體從長管通入;若只改變A裝置中的藥品,仍采用已連接的整套裝置,說明必須還用固液常溫型發生裝置和向上排空氣法收集裝置,所以只能是二氧化碳.
故答案為:adef;二氧化碳.
(4)濃硫酸可以吸收水分干燥氣體.
故答案為:干燥氣體.
(5)固體質量減少了1.6g,就是生成的氧氣的質量.
解:設剩余高錳酸鉀的質量為x.
2KMnO
4
K
2MnO
4+MnO
2+O
2↑
316 32
16g-x 1.6g

=
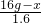
x=0.2g
答:剩余高錳酸鉀的質量為0.2g.
分析:(1)根據用高錳酸鉀制取氧氣的實驗的注意事項分析;根據用氯酸鉀和二氧化錳制氧氣的反應物、反應條件、生成物寫出化學反應式.
(2)根據信息:已知過氧化鈉(Na
2O
2)是一種淡黃色固體,常溫下可與水反應生成氫氧化鈉和氧氣,寫出化學方程式.
(3)用過氧化鈉和水反應來制取一瓶干燥的氧氣,需要用濃硫酸干燥后收集,用濃硫酸干燥時為充分吸收水分,要使氣體從長管通入.
(4)濃硫酸可以吸收水分干燥氣體.
(5)根據高錳酸鉀受熱分解生成錳酸鉀、二氧化錳和氧氣,可知由于氧氣的放出而使加熱一段時間后試管內固體質量減少,因此固體減少的質量就是生成的氧氣的質量,然后利用反應中各物質的質量關系計算出試管中剩余高錳酸鉀的質量.
點評:實驗室制取氧氣的實驗是初中化學的重點實驗,關于實驗中的注意事項、化學方程式的書寫、實驗裝置的連接、有關計算等問題都是考查的重點內容,對于與之相關問題同學們一定要了然于心.

 2KCl+3O2↑.
2KCl+3O2↑. 2KCl+3O2↑.
2KCl+3O2↑. K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑  =
=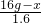


 新課標快樂提優暑假作業陜西旅游出版社系列答案
新課標快樂提優暑假作業陜西旅游出版社系列答案 暑假銜接培優教材浙江工商大學出版社系列答案
暑假銜接培優教材浙江工商大學出版社系列答案 (2012?天河區一模)(1)CO還原氧化銅的化學方程式是
(2012?天河區一模)(1)CO還原氧化銅的化學方程式是