
【題目】過濾操作中,下列實驗要求正確的是( )
A. 向過濾器中直接傾倒濾液B. 濾紙要緊貼漏斗內壁
C. 玻璃棒可任意輕靠在濾紙上D. 濾紙邊緣要高于漏斗邊緣
 通城學典默寫能手系列答案
通城學典默寫能手系列答案科目:初中化學 來源: 題型:
【題目】根據下圖所示裝置回答問題: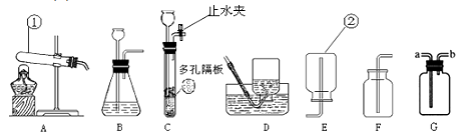
(1)寫出下列儀器的名稱:①。
(2)用氯酸鉀制取氧氣,選擇的發生裝置是 , 反應的化學方程式為。屬于反應,若用G來收集氧氣,氧氣應從(選“a”或“b”)進。
(3)實驗室制取二氧化碳,反應的化學方程式為 , 選擇的收集裝置是 , 制取二氧化碳最好選擇的發生裝置是C,與另一個裝置相比,其優點是。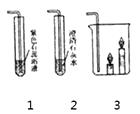
若C與1連接,則1中出現的現象是 , 原因是(用化學方程式表示)。
若C與3連接,則3中的現象是 , 由此說明了CO2的性質有、。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】分類是一種簡單有效的科學方法。小強對所學知識進行歸納,其中甲包含了乙、丙、丁。下列關系中沒有錯誤的一組是
甲 | 乙 | 丙 | 丁 | |
A | 常見的空氣污染物 | 二氧化碳 | 二氧化硫 | 一氧化碳 |
B | 常見的堿 | 燒堿 | 純堿 | 熟石灰 |
C | 常見的干燥劑 | 氫氧化鈉 | 生石灰 | 濃硫酸 |
D | 常見的合成材料 | 塑料 | 合金 | 合成纖維 |
A. AB. BC. CD. D
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下列說法中,錯誤的是( )
A. 熟石灰能與酸反應,所以可用來改良酸性土壤
B. 洗潔精有乳化作用,所以可用來洗滌餐具上的油污
C. 銨態氮肥能與堿反應,所以可與熟石灰混合施用
D. 濃硫酸有吸水性,所以可用來干燥O2、H2、CO2氣體
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下列關于S+O2![]() SO2的理解不正確的是( )
SO2的理解不正確的是( )
A.表示硫與氧氣在點燃條件下反應生成二氧化硫
B.參加反應的硫與氧氣的質量比是2:1
C.反應前后硫原子、氧原子的個數均不變
D.參加反應的氧氣與生成的二氧化硫的分子個數比為1:1
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】2019年我國成為世界環境日活動主辦國。下列做法不正確的是( )
A. 深埋電池,消除污染B. 合理使用農藥,保護水體資源
C. 植樹造林,凈化環境D. 垃圾分類回收,資源合理利用
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下列各組物質按單質、氧化物、混合物的順序排列的是( )
A. 海水、氧化鎂、氫氣B. 氮氣、冰水混合物、白酒
C. 空氣、二氧化碳、果汁D. 鎂、四氧化三鐵、氯化鈉
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某同學用量筒量取液體時,量筒平放在桌面上,當仰視凹液面最低處時,讀數為20mL,倒出部分液體后,小華又俯視凹液面的最低處讀數為10mL,則小華實際倒出液體的體積是( )
A. 大于10mLB. 小于10mLC. 等于10mLD. 無法判斷
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】早在春秋戰國時期,我國就開始生產和使用鐵器。工業煉鐵把鐵礦石和焦炭、石灰石一起加入高爐,在高溫下,利用焦炭與氧氣反應生成的一氧化碳把鐵從鐵礦石里還原出來。
(1)一氧化碳還原氧化鐵的化學方程式為:。其中,石灰石起的作用是。
(2)(一)甲組同學在學習煉鐵的相關內容時,對煉鐵時還原劑的選擇進行了如下探究。
【提出問題】
單質碳也具有還原性,碳還原氧化鐵的化學方程式為。為什么工業上不用焦炭作為還原劑直接還原鐵礦石?
(3)【猜想與假設】
焦炭和鐵礦石都是固體,接觸面積小,反應不易完全。
【進行實驗】
①稱取兩份相同質量的氧化鐵粉末。一份與足量的碳粉均勻混合放入圖1裝置A的試管中;另一份放入圖1裝置B的玻璃管中。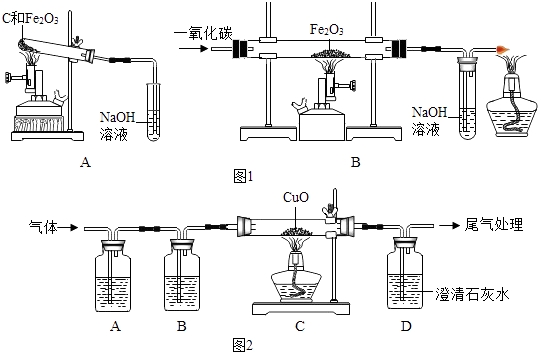
②圖1裝置A和B兩組實驗同時開始進行。在圖1裝置B的反應中,實驗開始前應先(選填“通CO”或“加熱”); 實驗結束后應繼續通入CO直至冷卻至室溫,其原因是。
(4)【實驗現象】
當圖1裝置B的玻璃管中固體完全由時(選填“紅色變為黑色”或“黑色變為紅色”),圖1裝置A的試管中仍有。
(5)【解釋與結論】
焦炭和鐵礦石都是固體,接觸面積小,反應確實不易完全,這可能是工業上不用焦炭作為還原劑直接還原鐵礦石的一個原因。
【完善實驗】
聯想到單質碳的一些化學性質,甲同學認為在碳還原氧化鐵的反應中可能還會有CO產生。為了證明碳還原氧化鐵所得的氣體中含有CO和CO2 , 將該氣體通過圖2的檢驗裝置。圖2A裝置中的試劑是(寫名稱,下同) , 圖2B裝置中的試劑是氫氧化鈉溶液,用以吸收二氧化碳(2NaOH+CO2═Na2CO3+H2O );證明原混合氣體中CO2存在的化學方程式;證明原混合氣體中CO存在的實驗現象是;經過檢驗,證實碳還原氧化鐵所得的氣體中確實含有CO和CO2。
(6)(二)精還原鐵粉是一種重要的化工原料,某興趣小組對其進行下列研究:
【物質制備】
利用綠礬制備精還原鐵粉的工藝流程如下:![]()
粗還原鐵粉中還含有少量鐵的氧化物和Fe3C雜質,可用氫氣在高溫下進一步還原,其反應方程式為FexOy+yH2 ![]() xFe+yH2O,Fe3C+2H2
xFe+yH2O,Fe3C+2H2 ![]() 3Fe+CH4。
3Fe+CH4。
【含量測定】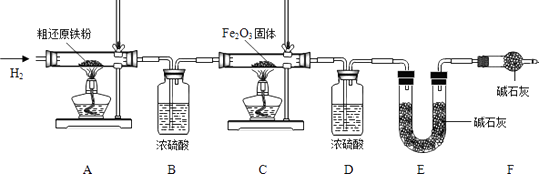
為得到精還原鐵粉并測定粗還原鐵粉中氧和碳元素的質量分數,按圖裝置進行實驗。
已知3CH4+4Fe2O3 ![]() 3CO2+6H2O+8Fe(假設每步反應都完全,且不考慮裝置內原有空氣對測定結果的影響)。
3CO2+6H2O+8Fe(假設每步反應都完全,且不考慮裝置內原有空氣對測定結果的影響)。
主要實驗步驟如下:
①按順序組裝儀器,檢查裝置的氣密性,稱量樣品和必要裝置的質量;
②緩緩通入純凈干燥的H2;
③點燃酒精燈,(填“先點A處,后點C處”或“先點C處,后點A處”);
④分別熄滅A處、C處酒精燈;
⑤再緩緩通入少量H2;
⑥再次稱量必要裝置的質量
(7)步驟②的目的是 , 驗證該步驟目的達到的實驗方法是;
(8)若缺少裝置D,則所測氧元素的質量分數將(填“偏大”,“偏小”或“不變”)。
(9)粗還原鐵粉樣品的質量為15.000g,裝置B、E分別增重0.270g和0.330g,則計算樣品出中碳、氧元素的質量分數分別是。(列出計算過程)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com