
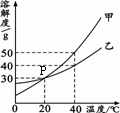
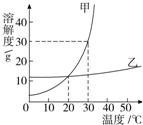
 甲、乙兩種固體物質的溶解度曲線如右圖所示.
甲、乙兩種固體物質的溶解度曲線如右圖所示.
 ×100%,可得飽和溶液中溶質的質量分數取決于該溫時的溶解度,而40℃甲的溶解度大于乙的溶解度,所以其溶質質量分數甲大于乙;60g放入100g水中升溫至40℃,此時乙的溶解度為40g,依據溶解度的定義,100g水中最多可溶40g乙,剩余20g乙不能溶解,即溶質質量與溶劑質量之比為:40g:100g=2:5.故答案為:>2:5;
×100%,可得飽和溶液中溶質的質量分數取決于該溫時的溶解度,而40℃甲的溶解度大于乙的溶解度,所以其溶質質量分數甲大于乙;60g放入100g水中升溫至40℃,此時乙的溶解度為40g,依據溶解度的定義,100g水中最多可溶40g乙,剩余20g乙不能溶解,即溶質質量與溶劑質量之比為:40g:100g=2:5.故答案為:>2:5; ×100%,可得飽和溶液中溶質的質量分數取決于該溫時的溶解度,而B與E溶液均為20℃時的飽和溶液,溶解度相同,則其溶質質量分數也相同.故答案為:AC E
×100%,可得飽和溶液中溶質的質量分數取決于該溫時的溶解度,而B與E溶液均為20℃時的飽和溶液,溶解度相同,則其溶質質量分數也相同.故答案為:AC E

 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
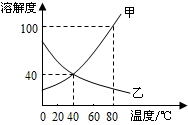
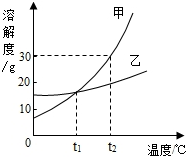 右圖是甲、乙兩種固體物質的溶解度曲線.下列說法正確的是( )
右圖是甲、乙兩種固體物質的溶解度曲線.下列說法正確的是( )| A、甲的溶解度隨溫度變化比乙小 | B、t2℃時甲的飽和溶液的溶質質量分數小于30% | C、t1℃時,甲、乙飽和溶液的溶質質量分數不相等 | D、可采用降低溫度的方法使乙的飽和溶液變為不飽和溶液 |
查看答案和解析>>
科目:初中化學 來源: 題型:
 ?
?查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com