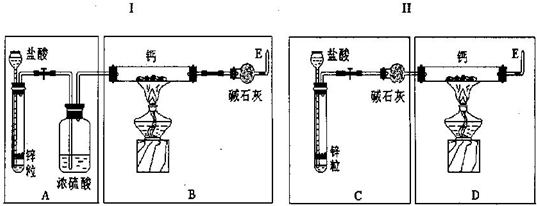
解:(1)鈣和氫氣在加熱的條件下生成氫化鈣,方程式是Ca+H
2 
CaH
2;故答案為:Ca+H
2 
CaH
2;
(2)由于鋅與鹽酸反應制得氣體氫氣中混有氯化氫和水蒸氣,會與鋅反應.濃硫酸只除去水蒸氣,故應增加除氯化氫裝置.故裝置Ⅰ的不足之處是制H
2裝置后缺少除HCl氣體的裝置;CaH
2易與水反應,為防空氣中水與CaH
2反應,應在制CaH
2裝置后加干燥裝置. 故裝置Ⅱ的不足之處是制CaH
2裝置后缺少干燥裝置.
故答案為:制H
2裝置后缺少除HCl氣體的裝置;制CaH
2裝置后缺少干燥裝置;
(3)C中堿石灰會把氫氣中的雜質氯化氫和水吸收,B中堿石灰可防止空氣中水蒸氣與CaH
2反應,故答案為:C、B;
(4)根據題給信息,反應物為CaH
2和水,產物為氫氣和氫氧化鈣,由此可寫出化學方程式為CaH
2+2H
2O=Ca(OH)
2+2H
2↑;
故答案為:CaH
2+2H
2O=Ca(OH)
2+2H
2↑;
(5)氫化鈣是固體,攜帶方便,與水作用,能很快產生氫氣,氫氣燃燒,放出的熱量很多且產物為水對空氣不造成污染.故與氫氣做能源相比它的優點是攜帶方便;
故答案為:攜帶方便.
分析:由于鹽酸易揮發,鋅與鹽酸反應制得氣體氫氣中混有氯化氫和水蒸氣,需先除去.因堿金屬或堿土金屬(Ⅱ族)與H
2在隔絕空氣加熱時發生反應,所以需把裝置中的空氣排凈.CaH
2與水反應產生H
2,故需要干燥環境.
點評:進行實驗評價時,可從實驗目的、裝置特點、題給信息及試劑性質綜合考慮.

 CaH2;故答案為:Ca+H2
CaH2;故答案為:Ca+H2  CaH2;
CaH2;