
以下是有關化學研究內容及化學史問題的研究:
(1)化學是研究物質的________、________、________以及________的科學.
(2)在古代,人類為了生存,在與自然界的種種災難進行抗爭的過程中,發現和利用了________,它的發現和利用,改善了人類的生存條件.________等銅礦在炭火上面燃燒,可制得紅色的________.
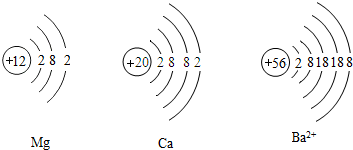
(3)________、阿伏加德羅提出原子論和分子學說,最早發現元素周期律的化學家是________.
(4)現在,化學家們已經能利用先進的儀器和分析技術對化學世界進行________的探索,并正在探索利用________技術.近年來,________的提出,使更多的化學工藝和產品向著環境友好的方向發展,化學必將使世界變得更加絢麗多彩.
科目:初中化學 來源: 題型:閱讀理解
| ||
| ||
查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
| ||
| ||
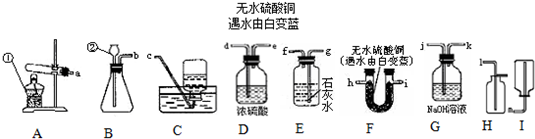
| 實驗次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| MnO2粉末用量(g) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 |
| 所用時間(t) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 |
查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
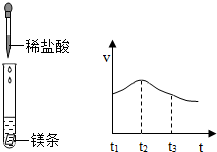
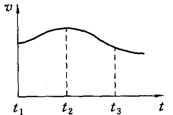
 以下是甲、乙兩同學對有關鎂與鹽酸反應的系列研究
以下是甲、乙兩同學對有關鎂與鹽酸反應的系列研究
| ||
| ||
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
 以下是甲、乙兩同學對有關鎂與鹽酸反應的系列研究
以下是甲、乙兩同學對有關鎂與鹽酸反應的系列研究查看答案和解析>>
科目:初中化學 來源:江蘇省模擬題 題型:實驗題
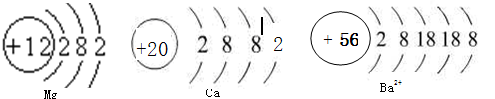
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com