
(7分)在公共場所進行衛生防疫時,消毒劑發揮著重要的作用。
(1)氫氧化鈉能殺滅細菌、病毒和寄生蟲卵等,它的俗名為 。
(2)過氧化氫溶液常用于傷口消毒。在生物酶的催化作用下,過氧化氫可發生分解反應,化學方程式為 。
(3)過氧乙酸(CH3COOOH)是被廣泛使用的高效消毒劑,它不穩定易分解放出一種常見的氣體單質,并生成醋酸(CH3COOH),該反應的化學方程式為 ;若一瓶19%的過氧乙酸溶液因久置而完全分解,所得溶液中醋酸的質量分數為 (結果保留一位小數)。
(4)2008年5月12日汶川特大地震導致災區部分水源嚴重污染,為保障當地群眾飲水安全,有關衛生防疫部門使用了多種消毒劑進行殺菌、消毒。主要有:凈水片(Na2FeO4)、優氯凈(C3O3N3Cl2Na)、二氧化氯(C1O2)、“84”消毒液(有效成分為NaClO)。
①制取Na2FeO4的反應為:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O,X的化學式為 。
②下列有關說法正確的是 。
A.消毒殺菌的過程是化學變化
B.C3O3N3Cl2Na的相對分子質量為232.5
C.C3O3N3Cl2Na中C、O元素的質量比為3:4
D.ClO2、NaClO和C3O3N3Cl2Na中均含氯元素,ClO2中氯元素的質量分數最大
(1)燒堿(或火堿、苛性鈉) (2)2H2O2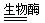 2H2O+O2↑
2H2O+O2↑
(3)2CH3COOOH====2CH3COOH+ O2↑ 15.6%
(4)①NaCl ② ACD(答對2個得1分,錯答得0分)
【解析】
試題分析:(1)氫氧化鈉俗稱燒堿、火堿、苛性鈉;
(2)根據題意,結合學過的過氧化氫的分解分析可知,在生物酶的催化作用下,過氧化氫可發生分解生成水和氧氣,故化學方程式為2H2O2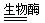 2H2O+O2↑;
2H2O+O2↑;
(3)根據題意可知,過氧乙酸(CH3COOOH)易分解放出一種常見的氣體單質,并生成醋酸(CH3COOH),結合質量守恒定律可知,該常見的氣體單質為氧氣,故該反應的化學方程式為2CH3COOOH=2CH3COOH+ O2↑;
過氧乙酸能分解生成醋酸和氧氣,要求所得溶液中醋酸的質量分數,需要求得醋酸的質量,可設過氧乙酸溶液質量為100g,則溶質過氧乙酸的質量為100g×19%=19g,水的質量為:100g-19g=81g,再設生成的醋酸的質量為x,則有
2CH3COOOH==2CH3COOH+ O2↑
152 120
19g x
152:120=19g:x
解得x=15g
所以所得溶液中醋酸的質量分數為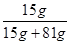 ×100%=15.6%
×100%=15.6%
(4)①根據質量守恒定律,在化學反應過程中,原子的種類和個數不變,即化學方程式左右兩邊原子種類、個數相同;結合題干中的化學方程式可知,左邊比右邊多3個Na原子和3個Cl原子,故X的化學式為NaCl;
②結合題意及化學式分析。
A、消毒殺菌的過程是發生氧化還原反應的過程,故A正確;
B、C3O3N3Cl2Na的相對分子質量=12×3+16×3+14×3+35.5×2+23=220,故B錯誤;
C.C3O3N3Cl2Na中C、O元素的質量比=(12×3):(16×3)=3:4,故C正確;
D.ClO2、NaClO和C3O3N3Cl2Na中均含氯元素,要比較其中氯元素的質量分數,可先將每個化學式中的Cl變成1個,則化學式的相對分子量越小,氯元素的質量分數就越大,由此可知,ClO2中氯元素的質量分數最大,故D正確。故選ACD
考點:書寫化學方程式,相對分子質量的概念及其計算,元素質量比的計算,元素的質量分數計算,質量守恒定律及其應用,根據化學反應方程式的計算
點評:本題是一道綜合題,側重于計算,所以熟練掌握化學式的計算,是解答本題的關鍵。


科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
| ||
| ||
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com