解:(1)100g溶質質量分數為12.5%的NaCl溶液的步驟:計算、稱量(量取)、溶解、裝瓶貼簽,用圖示的序號表示為:④②①⑤③.
(2)圖③中玻璃棒用于溶解時的攪拌,促進溶解.
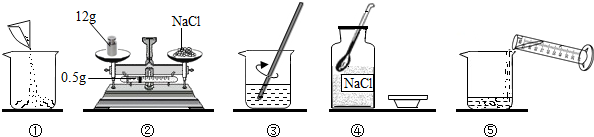
(3)溶質質量=溶液質量×溶質的質量分數,配制100g溶質質量分數為12.5%的NaCl溶液,需氯化鈉的質量=100g×12.5%=12.5g;溶劑質量=溶液質量-溶質質量,則所需蒸餾水的質量=100g-12.5g=87.5g;水的密度為1g/cm
3,則根據V=
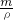
=

=87.5cm
3=87.5mL,故應選用100mL的量筒.
(4)托盤天平的使用要遵循“左物右碼”的原則,圖②中氯化鈉與砝碼的位置顛倒;由左盤的質量=右盤的質量+游碼的質量可知:砝碼質量=藥品質量+游碼的質量,所以藥品質量=砝碼質量-游碼質量,即藥品質量=12g-0.5g=11.5g.
故答案為:(1)④②①⑤③;(2)攪拌促進溶解;(3)100;(4)圖②中氯化鈉與砝碼的位置顛倒;圖④瓶蓋沒有倒放;11.5.
分析:(1)根據配制溶質質量分數一定的溶液的基本步驟進行分析解答.
(2)根據配制溶質質量分數一定的溶液中玻璃棒的作用進行分析解答.
(3)利用溶質質量=溶液質量×溶質的質量分數,可根據溶液的質量和溶質的質量分數計算配制溶液所需要的溶質的質量;再根據溶劑質量=溶液質量-溶質質量即可求得蒸餾水的質量、體積,進而可確定所需量筒的量程.
(4)托盤天平的使用要遵循“左物右碼”的原則,如果位置放反,根據左盤的質量=右盤的質量+游碼的質量,列等式進行計算.
點評:本題難度不大,明確配制一定溶質質量分數的溶液實驗步驟、所需的儀器與作用等是正確解答本題的關鍵.

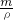 =
= =87.5cm3=87.5mL,故應選用100mL的量筒.
=87.5cm3=87.5mL,故應選用100mL的量筒.

 期末1卷素質教育評估卷系列答案
期末1卷素質教育評估卷系列答案