用一塊含雜質2.1%的生鐵28.6克(假設雜質不參加化學反應)與溶質質量分數為20%的稀硫酸溶液恰好完全反應:Fe+H2S04=FeS04+H2↑,過濾.求:
(1)該生鐵塊含純鐵多少克?
(2)反應生成氫氣多少克?
(3)反應需要此稀硫酸溶液多少克?
(4)反應后所得濾液的溶質質量分數是多少?
(5)用98%的濃硫酸(密度為1.84g?cm-3)100毫升,可以配制此20%的稀硫酸多少克?(計算結果不為整數的保留一位小數)
解:(1)該生鐵塊含純鐵的質量為:28.6g×(1-2.1%)≈28.0g;
(2)設反應生成氫氣質量是x,反應的硫酸的質量是y,生成硫酸亞鐵的質量是z
Fe+H
2S0
4=FeS0
4+H
2↑
56 98 152 2
28g y z x
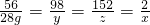
x=1g y=49g z=76g
(3)反應需要此稀硫酸溶液的質量是
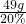
=245g;
(4)反應后所得濾液的溶質質量分數是:
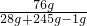
×100%≈27.9%;
(5)依據設可配置此20%的稀硫酸的質量是w
100mL×1.84g/mL×98%=w×20%
w=901.6g
答:(1)該生鐵塊含純鐵28.0克;(2)反應生成氫氣1克;(3)反應需要此稀硫酸溶液245克;(4)反應后所得濾液的溶質質量分數是27.9%(5)用98%的濃硫酸(密度為1.84g?cm
-3)100毫升,可以配制此20%的稀硫酸901.6克.
分析:(1)根據生鐵的含鐵質量分數進行計算;
(2)依據鐵的質量利用方程式Fe+H
2S0
4=FeS0
4+H
2↑可求氫氣的質量;
(3)依據鐵的質量利用方程式Fe+H
2S0
4=FeS0
4+H
2↑可求硫酸的質量,而后利用硫酸的溶質質量分數可求溶液的質量;
(4)依據鐵的質量利用方程式Fe+H
2S0
4=FeS0
4+H
2↑可求生成的硫酸亞鐵的質量,而后求出反應后溶液的質量(鐵的質量+硫酸溶液的質量-氫氣的質量),即可得溶液的溶質質量分數;
(5)依據溶液稀釋前后溶質的質量不變分析解答;
點評:本題主要考查含雜質物質的化學方程式計算和溶質質量分數的計算,難度不大但較為繁瑣;

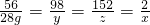
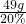 =245g;
=245g;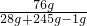 ×100%≈27.9%;
×100%≈27.9%;
