
某同學為測定10g某赤鐵礦石中氧化鐵的質量分數,利用稀硫酸和鋅粒制取氫氣,設計了下圖所示的裝置,進行有關的實驗探究(提示:3H2+Fe2O3 2Fe+3H2O;雜質不參加反應,假定每步均完全反應或吸收)。請回答有關問題:
2Fe+3H2O;雜質不參加反應,假定每步均完全反應或吸收)。請回答有關問題:
得到如下數據:
| 裝置 | B | C |
| 反應前質量 | 84.3g | 294.1g |
| 反應后質量 | 81.9g | 296.8g |
(1)80%;(2)H:O=[(296.8g-294.1g)-(84.3g-81.9g)]:(84.3g-81.9g) 不變
解析試題分析:解:氧元素的質量為84.3g—81.9g = 2.4g
氧化鐵中氧元素的質量分數為
氧化鐵的質量為
赤鐵礦石樣品中氧化鐵的質量分數為:
(2)根據題目中表格中的實驗數據,反應產生的水的質量為296.8g-294.1g,此水中氧元素的質量為84.3g-81.9g,所以由表中實驗數據可知水中氫、氧元素的質量比為H:O=[(296.8g-294.1g)-(84.3g-81.9g)]:(84.3g-81.9g),若玻璃管中的氧化鐵沒有完全反應,則求得水中氫、氧元素的質量比不會發生變化,因為側得的水的質量以及測的的其中氧元素的質量均是同比例減小,比值不變。
考點:質量守恒定律的應用
點評:此題是關于質量守恒定律的應用方面的題目,屬于中考的熱點題目,可在選擇題、填空題和計算題中出現,考查形式較為靈活,注意仔細審題。


科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源:2013年江蘇省南京市鼓樓區中考二模化學試卷(解析版) 題型:計算題
某同學為測定10g某赤鐵礦石中氧化鐵的質量分數,利用稀硫酸和鋅粒制取氫氣,設計了下圖所示的裝置,進行有關的實驗探究(提示:3H2+Fe2O3 2Fe+3H2O;雜質不參加反應,假定每步均完全反應或吸收)。請回答有關問題:
2Fe+3H2O;雜質不參加反應,假定每步均完全反應或吸收)。請回答有關問題:

得到如下數據:
|
裝置 |
B |
C |
|
反應前質量 |
84.3g |
294.1g |
|
反應后質量 |
81.9g |
296.8g |
(1)請計算該赤鐵礦石樣品中氧化鐵的質量分數。(寫出計算過程)
(2)該實驗還可測定組成水中各元素之間的質量關系,請用表中實驗數據列式表示出水中氫、氧元素的質量比為_______________________________________________(只列式,不計算);若玻璃管中的氧化鐵沒有完全反應,則求得水中氫、氧元素的質量比會__________(選填“偏大”、“偏小” 或“不變”)。
查看答案和解析>>
科目:初中化學 來源: 題型:
某同學為測定10g某赤鐵礦石中氧化鐵的質量分數,利用稀硫酸和鋅粒制取氫氣,設計了下圖所示的裝置,進行有關的實驗探究(提示:3H2+Fe2O3 2Fe+3H2O;雜質不參加反應,假定每步均完全反應或吸收)。請回答有關問題:
2Fe+3H2O;雜質不參加反應,假定每步均完全反應或吸收)。請回答有關問題:
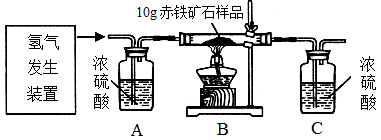
得到如下數據:
| 裝置 | B | C |
| 反應前質量 | 84.3g | 294.1g |
| 反應后質量 | 81.9g | 296.8g |
(1)請計算該赤鐵礦石樣品中氧化鐵的質量分數。(寫出計算過程)
(2)該實驗還可測定組成水中各元素之間的質量關系,請用表中實驗數據列式表示出水中氫、氧元素的質量比為_______________________________________________(只列式,不計算);若玻璃管中的氧化鐵沒有完全反應,則求得水中氫、氧元素的質量比會__________(選填“偏大”、“偏小” 或“不變”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com