
(9分)已知 Na2CO3的水溶液呈堿性,在一燒杯中盛有21.4g Na2CO3和NaCl組成的固體混合物。向其中逐漸滴加溶質質量分數為10%的稀鹽酸。放出氣體的總質量與所滴入稀鹽酸的質量關系曲線如圖所示,請根據題意回答問題:
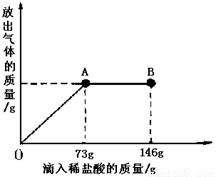
(1)當滴加稀鹽酸至圖中A點時,放出氣體的質量是 g
(2)當滴加稀鹽酸至圖中B點時,燒杯中溶液的溶質是 。
(3)當滴加稀鹽酸至圖中A點時,燒杯中為不飽和溶液(常溫),通過計算求出其中溶質的質量分數。
(1)4.4 (2)NaCl HCl (3)25%
【解析】①根據放出氣體的總質量與所滴入稀鹽酸的質量關系曲線圖,當滴加了73g稀鹽酸時恰好完全反應,生成二氧化碳4.4g,故答案為:4.4;
②因由圖可知在A點時恰好完全反應,再繼續加鹽酸不發生反應,則在B點時鹽酸過量,溶液中的溶質為HCl、NaCl,故答案為:HCl、NaCl;
(3)解:設樣品中碳酸鈉質量為x,生成氯化鈉質量為y,生成二氧化碳質量為z
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x 73g×10% y z
x/106=73g×10%/73=y/117=z/44
x=10.6g y=11.7g z=4.4g
反應后溶液中:溶質NaCl:(21.4-10.6)g+11.7g=22.5g
溶液的質量:21.4g+73g-4.4g=90g
反應后的溶液的溶質質量分數=22.5g/90g×100%=25%


 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源:2012屆湖南省株洲市天元區九年級學業水平模擬考試化學試卷(帶解析) 題型:計算題
(9分)已知 Na2CO3的水溶液呈堿性,在一燒杯中盛有21.4g Na2CO3和NaCl組成的固體混合物。向其中逐漸滴加溶質質量分數為10%的稀鹽酸。放出氣體的總質量與所滴入稀鹽酸的質量關系曲線如圖所示,請根據題意回答問題: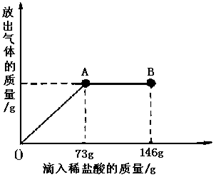
(1)當滴加稀鹽酸至圖中A點時,放出氣體的質量是 g
(2)當滴加稀鹽酸至圖中B點時,燒杯中溶液的溶質是 。
(3)當滴加稀鹽酸至圖中A點時,燒杯中為不飽和溶液(常溫),通過計算求出其中溶質的質量分數。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com