
【題目】分類、類比是學習化學常用的方法。
(1)初中化學實驗方法有多種,如對比法、控制變量法、定量實驗法、定性實驗法等,若按實驗方法分類,應將實驗 ________________________(填字母)分為一類,依據是______________________________。
用pH 試紙測定溶液的pH |
探究鐵生銹條件 |
探究氫氧化鈉溶液與鹽酸反應 |
配置質量分數5%的NaCl 溶液 |
A | B | C | D |
(2)善于比較、歸納是良好的學習習慣。酸酐能與水化合生成相應的酸。依據酸酐中元素的化合價與酸中元素的化合價存在的規(guī)律,寫出硝酸酸酐的化學式__________________;請寫出三氧化二氮與水反應生成相應酸的化學方程式_______________________。
酸酐 | 酸 | 酸酐 | 酸 |
CO2 | H2CO3 | SO3 | H2SO4 |
Cl2O7 | HClO4 | ? | HNO3 |
【答案】AC 均屬于定性實驗法 N2O5 N2O3+H2O═2HNO2
【解析】
(1)實驗A是用pH 試紙測定溶液的pH,屬于定性實驗法;C是探究氫氧化鈉溶液與鹽酸反應,也屬于定性實驗法,故按實驗方法分類,應將實驗AC分為一類;
(2)酸酐中元素的化合價與酸中元素的化合價存在的規(guī)律,酸酐中氧元素之外的另一種元素的化合價等于酸中氫、氧之外的該元素的化合價,硝酸中氮元素顯+5價,氧元素顯-2價,則硝酸酸酐的化學式為N2O5;
三氧化二氮中氮元素的化合價為+3價,與水反應生成酸是亞硝酸,反應的化學方程式為N2O3+H2O═2HNO2。
故答案為:
(1)AC;均屬于定性實驗法;
(2)N2O5;N2O3+H2O═2HNO2


 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:
【題目】在化學學習中,了解知識的發(fā)展歷程,可以促進我們正確理解科學本質。
(1)火藥起源于唐朝。制作煙花的火藥中加入鎂粉,是為了引燃后能看到______________。
(2)十八世紀,化學家發(fā)現某些金屬與酸反應能生成一種氣體,該氣體被稱為“會制造水的物質”。寫出該氣體燃燒制造水的化學方程式:______________。
(3)俄國化學家貝開托夫于1865年發(fā)表了金屬活動性順序。某同學將鋁片放入氯化銅溶液中,發(fā)現有紅色固體和無色氣體生成。
①寫出生成紅色固體的化學方程式:_______________。
②利用溫度傳感器和pH傳感器監(jiān)測實驗過程中的相關數據(如圖所示),
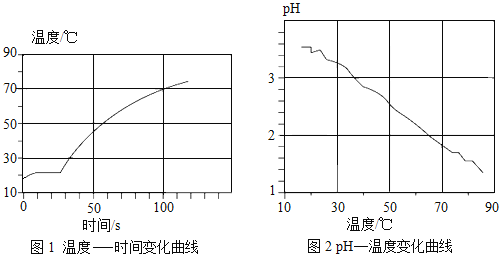
說明該過程_________(“放熱”或“吸熱”),溶液的酸性_______(“增強”或“減弱”);推測鋁與溶液中的H+反應生成無色氣體是_______________(填物質化學式)。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】用適當化學用語填空:
(1)3個亞鐵離子_____;
(2)氦氣_____;
(3)最簡單的有機物_____;
(4)保持氧氣的化學性質的微粒_____;
(5)標出純堿中金屬元素的化合價_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】研究元素知識是學好化學的基礎,如表包含部分元素的相關信息,請完成填空。
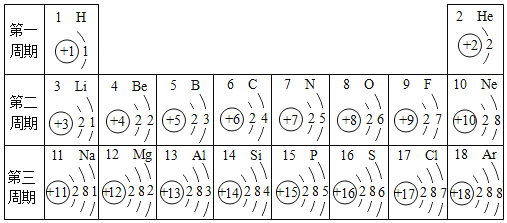
(1)1869年,俄國化學家_____發(fā)現了元素周期律并編制了元素周期表;
(2)用正確的化學用語填空:兩個氫原子_____;2個氧分子_____;3個亞鐵離子_____;氧化鋁中鋁元素顯+3價_____
(3)下列圖中微粒共表示_____種元素,其中與氯元素具有相似化學性質的是_____![]() 填序號
填序號![]() 。其中D元素位于第_____周期。
。其中D元素位于第_____周期。
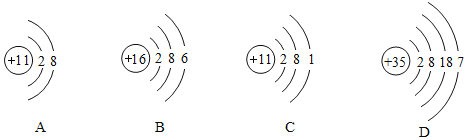
(4)寫出原子序數為1、6、8、11四種元素所組成化合物的化學式_____。
(5)通過分析,同一橫行元素之間的排列有一定的規(guī)律,如:①從左到右,由金屬元素逐漸向非金屬元素過渡;②從左到右,各元素原子的電子層數相同;③_____(任寫一條)。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下列敘述正確的是( )
A. 油脂是重要的營養(yǎng)物質,正常情況下,每人每天需要攝入![]()
B. 廢電池中含有鉛、鎳、鎘、汞,若隨意丟棄會造成地下水和土壤污染
C. 碘是甲狀腺素的重要成分,患有甲狀腺腫大的病人應禁止碘的攝入
D. 食品添加劑雖然都是化學合成物質,但可以改善食品品質,可以適量使用
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某工廠欲測定鋁土礦中A12O3的含量,將礦石粉碎(其中雜質既不溶于水也不與酸反應),進行如下實驗:
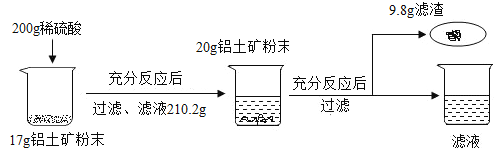
請回答下列問題:
(1)上述實驗過程中發(fā)生反應的化學方程式為_____;
(2)鋁土礦中A12O3的質量分數為_____;
(3)根據已知條件列出求解200g稀鹽酸中溶質質量(X)的比例式_____;
(4)若將最終所得溶液蒸發(fā)掉20.4g水,所得不飽和溶液中溶質的質量分數為_____;
(5)用濃鹽酸配置上述稀鹽酸,需要的儀器有:燒杯、量筒、膠頭滴管和_____;
(6)該煉鋁廠每天用上述鋁土礦170t來生產鋁合金,則理論上日產含鎂46%的鋁鎂合金的質量為_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】NiSO46H2O是一種綠色易溶于水的晶體,廣泛用于化學鍍鎳、生產電池等,可由電鍍廢渣(除含鎳外,還含有Cu、Zn、Fe等雜質)為原料獲得。有關工藝流程如圖:
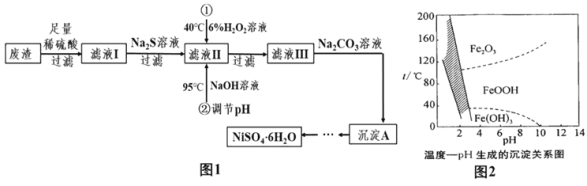
(相關資料)①Ni能與稀硫酸反應生成NiSO4和H2
②ZnSO4+Na2S=ZnS↓+Na2SO4
③H2O2溶液能將FeSO4氧化成Fe2(SO4)3
④NiCO3是一種不溶于水、易溶于強酸的淺綠色沉淀。
(問題解答)
(1)向廢渣中加入足量稀硫酸的目的是_____。
(2)在濾液Ⅱ中加入H2O2溶液時,溫度不能太高的原因是_____。
(3)除鐵時還能加入適量的Na2CO3溶液調節(jié)酸度,反應生成Na2SO4、CO2氣體和一種淺黃色的黃鐵礬鈉沉淀[化學式為:Na2Fe6(SO4)4(OH)12],這樣可以將Fe3+除去。寫出該反應的化學方程式_____。如圖是溫度—pH與生成的沉淀關系圖,圖中陰影部分是黃鐵礬鈉穩(wěn)定存在的區(qū)域。下列說法正確的是_____(填序號)。
A FeOOH中鐵元素為+2價
B Fe2O3固體為紅色
C 若在25℃時,用H2O2氧化Fe2+,再在pH=4時除去鐵,此時溶液中出現的沉淀是FeOOH和Fe(OH)3
D 工業(yè)生產中常保持在85~95℃生成黃鐵礬鈉,此時水體的pH為1.5左右
(4)從“沉淀A”制得NiSO46H2O晶體的實驗步驟依次為:向沉淀中加入_____溶液,直至恰好完全溶解,轉化為NiSO4溶液;蒸發(fā)濃縮、冷卻結晶,過濾得NiSO46H2O晶體,用少量乙醇洗滌NiSO46H2O晶體并晾干。
查看答案和解析>>
科目:初中化學 來源: 題型:
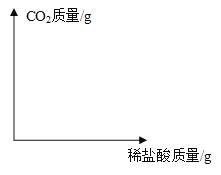
【題目】實驗室有一份在空氣中潮解部分變質的氫氧化鈉樣品,質量為1.86g。某實驗小組將這份樣品完全溶解,配成 50g 溶液,然后緩慢滴入 7.3%的稀鹽酸,同時進行攪拌,使二氧化碳全部逸出。滴加過程中,多次測得溶液 pH 和溶液總質量,部分數據如下表所示:
測量次數 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 | 第 5 次 |
滴加的鹽酸總質量/g | 0 | 5 | 20 | 30 | 35 |
溶液總質量/g | 50 | 55 | 69.56 | 79.56 | 84.56 |
溶液 pH | 12.4 | 12.1 | 7.0 | 2.2 | 2.1 |
請分析計算:
(1)氫氧化鈉變質是與空氣中的_________________反應。
(2)實驗中生成二氧化碳的質量為___________________g。
(3)求樣品中氫氧化鈉的質量___________________。
(4)請在下圖中畫出稀鹽酸質量與二氧化碳質量關系的圖像___________________(溫馨提醒:標出關鍵點的數據)。
(5)當恰好完全反應時,該溶液的溶質質量分數是_________。(結果保留一位小數)。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】我們的初中化學實驗中有很多都與氣壓變化有關,請回答下列問題:
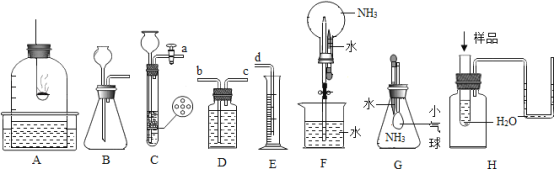
(1)如圖A裝置用紅磷測定空氣中氧氣的體積分數,請寫出化學方程式:_____,充分反應后,應先______,再讀數,否則測得結果將_____![]() (填“大于”、“等于”或“小于”)。
(填“大于”、“等于”或“小于”)。
(2)實驗室可用注射器連接到裝置 B 的導管處,檢查裝置B的氣密性.實驗步驟:向錐形瓶中加水至____,向后拉動注射活塞,若觀察到______時,則說明裝置B氣密性良好。
(3)實驗室利用裝置C制備H2,化學方程式為_____,相比較裝置B,它的優(yōu)點是_____,若選用裝置D、E測定生成H2的體積,儀器連接順序為a→____→______→d。
(4)裝置F和G可用于驗證NH3極易溶于水,F裝置的實驗現象是______,G裝置的實驗現象是_____。
(5)在裝置H中,某樣品投入到水中,右側U型管出現液面左低右高現象,則該樣品不可能是____。
① CaO ② NaOH固體 ③ 濃硫酸 ④ NH4NO3固體.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com