
| 實驗一 | 實驗二 | |
| 實驗 過程 |
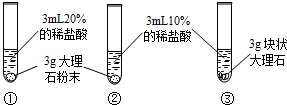 |
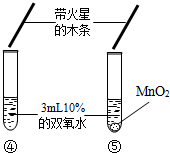 |
| 實驗現象 | 大理石表面冒氣泡,試管外壁微熱.試管①、②、③中產生氣泡快慢的順序為:①>②>③. | 試管④中無明顯現象,⑤中可觀察到大量的氣泡,兩只試管上方的木條均未復燃. |
| 分析與 結論 |
(1)大理石與稀鹽酸反應的化學方程式為 CaCO3+2HCl=CaCl2+H2O+CO2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ ;(2)對比實驗①②可知, 反應物的濃度越大 反應物的濃度越大 ,化學反應的速度越快;對比實驗②③ ②③ (填實驗序號)可知,反應物的接觸面積越大,化學反應的速度越快. |
(1)對比實驗④⑤可知,影響化學反應速度的因素還有 催化劑 催化劑 ;(2)試管⑤中產生了大量氧氣,但是木條卻未復燃,可能的一種原因是 氧氣中混有水蒸氣 氧氣中混有水蒸氣 . |


科目:初中化學 來源: 題型:
| 高溫 |
 +4Cu
+4Cu ”內對應產物的化學式為
”內對應產物的化學式為查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com