
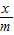 =
=
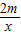
 =+2,所以其相對分子質(zhì)量也可以變?yōu)椋?7×
=+2,所以其相對分子質(zhì)量也可以變?yōu)椋?7× =18,所以質(zhì)量相同的Al、Mg、Fe、Zn分別與足量的稀硫酸反應(yīng),產(chǎn)生氫氣的質(zhì)量依次減小.分析所給的選項可以知道選項D是正確的.
=18,所以質(zhì)量相同的Al、Mg、Fe、Zn分別與足量的稀硫酸反應(yīng),產(chǎn)生氫氣的質(zhì)量依次減小.分析所給的選項可以知道選項D是正確的.

科目:初中化學(xué) 來源: 題型:
 (2005?白下區(qū)一模)某校化學(xué)活動小組為探究X、Y、Z三種金屬與酸的反應(yīng)情況,進行了如下實驗:取等質(zhì)量的X、Y、Z分別與足量的溶質(zhì)質(zhì)量分?jǐn)?shù)相等的稀硫酸反應(yīng),都生成+2價金屬的硫酸鹽,反應(yīng)情況如右圖所示.下列對該圖象理解的敘述中,正確的是( )
(2005?白下區(qū)一模)某校化學(xué)活動小組為探究X、Y、Z三種金屬與酸的反應(yīng)情況,進行了如下實驗:取等質(zhì)量的X、Y、Z分別與足量的溶質(zhì)質(zhì)量分?jǐn)?shù)相等的稀硫酸反應(yīng),都生成+2價金屬的硫酸鹽,反應(yīng)情況如右圖所示.下列對該圖象理解的敘述中,正確的是( )查看答案和解析>>
科目:初中化學(xué) 來源: 題型:單選題
查看答案和解析>>
科目:初中化學(xué) 來源:不詳 題型:單選題
| A.Al>Mg>Zn>Fe | B.Al>Fe>Mg>Zn |
| C.Al>Zn>Fe>Mg | D.Al>Mg>Fe>Zn |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com