酸雨給人類生活和社會發展帶來了嚴重危害.汽車尾氣是導致酸雨的重要原因,為減少有害氣體的排放,人們在汽車排氣管上安裝“催化轉化器”,使尾氣中的一氧化碳和一氧化氮轉化為空氣中體積分數最多的氣體和CO2.回答下列問題:
(1)寫出轉化的化學方程式:______.
(2)化學反應中,元素的化合價升高,則該元素所在的反應物是還原劑,反之則為氧化劑.那么上述反應中的NO是______劑.
(3)上述反應產生的CO2大量排放會導致______,植樹造林、低碳環保刻不容緩.
(4)實驗室,若要充分吸收大量的CO2,下列試劑中最合適的是______.
A、水 B、澄清石灰水 C、飽和氫氧化鈉溶液.
解:(1)由題干的信息可知該反應的反應物是一氧化碳和一氧化氮,生成物是氮氣與二氧化碳,其化學方程式為2CO+2NO

N
2+2CO
2;
(2)因為化學反應中,元素的化合價升高,則該元素所在的反應物是還原劑,反之則為氧化劑,在該反應中反應前氮元素化合價為+2價,反應后氮的化合價變為0價,所以NO應該是該反應的氧化劑.
(3)大氣中二氧化碳的含量升高容易導致溫室,所以該反應中二氧化碳氣體的大量排放容易導致溫室效應的產生;
(4)A、依據水能溶解二氧化碳的能力是室溫下1體積水能溶解1體積的二氧化碳,可知水吸收二氧化碳的能力不強,不適宜吸收大量的二氧化碳;
B、氫氧化鈣能與二氧化碳反應,所以能吸收二氧化碳,但由于氫氧化鈣是微溶物,所以澄清石灰水中氫氧化鈣的量不大,因此不適宜吸收大量的二氧化碳;
C、氫氧化鈉能與二氧化碳反應,所以能吸收二氧化碳,且氫氧化鈉易溶于水,常溫下其溶解度較大,因此適宜吸收大量的二氧化碳;
故答案為:(1)2CO+2NO

N
2+2CO
2;(2)氧化;(3)溫室效應;(4)C;
分析:(1)依據題干的信息結合化學方程式的書寫規則書寫方程式即可;
(2)依據題干中氧化劑與還原劑的化合價升降分析解答即可;
(3)依據溫室效應的產生原因進行分析;
(4)從溶液與二氧化碳的反應及物質的溶解性進行分析判斷;
點評:此題是一道與環保相關的題目,均是所學基礎知識的相關衍生題,體現了化學基礎知識的重要性.

 N2+2CO2;
N2+2CO2; N2+2CO2;(2)氧化;(3)溫室效應;(4)C;
N2+2CO2;(2)氧化;(3)溫室效應;(4)C;

 發散思維新課堂系列答案
發散思維新課堂系列答案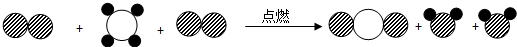
 ”表示碳原子,“
”表示碳原子,“ ”表示氫原子,“
”表示氫原子,“ ”表示氧原子,該反應的化學方程式為
”表示氧原子,該反應的化學方程式為