
(10分)課外化學興趣小組的同學利用某化工廠的廢堿液(主要成分為Na2CO3、還含有少量NaCl,其它雜質不計)和石灰乳(氫氧化鈣的懸濁液)為原料制備燒堿,并對所得的燒堿粗產品的成分進行分析和測定。
【粗產品制備】
(1)將廢堿液加熱蒸發濃縮,形成較濃的溶液,冷卻后與石灰乳混合,發生反應的化學方程式為 。
(2)將反應后的混合物過濾,得到的濾液進行蒸發結晶,制得NaOH粗產品。
【粗產品成分分析】
(1)取適量粗產品溶于水,加入Ba(NO3)2溶液出現白色渾濁,該反應的化學方程式為 ,由此該粗產品中一定不含有 。
(2)該小組同學通過對粗產品成分的實驗分析,確定該粗產品中含有三種物質。
【含量測定】Na2CO3含量的測定
(1)該興趣小組的同學設計了下圖所示的實驗裝置。取20.0g粗產品,進行實驗。
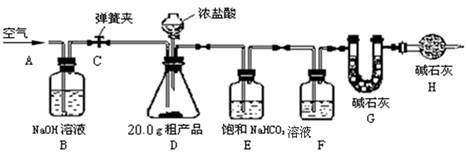
【說明】 ①堿石灰是CaO與NaOH的固體混合物。
②CO2在飽和NaHCO3溶液中的溶解度非常小。
(2)操作步驟:
①連接好裝置,檢查氣密性;將藥品加入各裝置
②打開彈簧夾C,在A處緩緩通入一段時間空氣;
③稱量G的質量;
④關閉彈簧夾C,慢慢滴加濃鹽酸,直至D中無氣泡冒出;
⑤打開彈簧夾C,再次緩緩通入一段時間空氣;
⑥再次稱量G的質量,得前后兩次質量差為0.48g。
(3)問題探究:
①在用托盤天平稱量粗產品時,如果天平的指針向右偏轉,說明 。
②B裝置的作用是 。
③在步驟②中,A處緩緩通入一段時間空氣的目的是 。
④若沒有H裝置,則測定的Na2CO3的質量分數會 (填“偏大”、“偏小”、“不變”)。
⑤該興趣小組指導老師認為該方案有些不合理,指導同學們更換了其中的一種試劑并去掉了一個裝置后實驗得到了完善,并測得20.0 g粗產品只能產生0.44 g CO2 。你認為更換后的試劑是 ,原實驗中實驗值0.48g比正確值0.44 g偏大的原因是(假設操作均正確) 。(4)數據計算:
根據正確值0.44 g,求得粗產品中Na2CO3的質量分數是 (寫出計算過程)。
【粗產品制備】(1) Na2CO3+Ca(OH)2═CaCO3↓+2NaOH 。
【粗產品成分分析】(1) Ba(NO3)2+Na2CO3═BaCO3↓+2NaNO3 , Ca(OH)2 。
【含量測定】Na2CO3含量的測定:
(3)問題探究:
① 樣品質量不足 ;② 吸收除去空氣中的二氧化碳,以免對實驗干擾 ;
③ 排盡裝置內空氣(中的二氧化碳氣體),以免對實驗干擾; ④ 偏大
⑤ 稀硫酸 ; 濃鹽酸有揮發性,產生的二氧化碳中含HCl氣體與碳酸氫鈉溶液反應又產生二氧化碳
(4)數據計算: 5.3% 。
說明:化學方程式、計算過程、最終結果均正確才給分。
【解析】:【粗產品制備】
(1)氫氧化鈣和碳酸鈉反應生成碳酸鈣沉淀和氫氧化鈉,故答案為:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,
【粗產品成分分析】
(1)碳酸鈉能和硝酸鋇反應生成沉淀,化學方程式為:Na2CO3+Ba(NO3)2═BaCO3↓+2NaNO3,因為氫氧化鈣和碳酸鈉能反應,所以一定沒有氫氧化鈣,.
由上可知一定有碳酸鈉存在,而碳酸鈉與氫氧化鈣在溶液中不能共存.
【含量測定】Na2CO3含量的測定:
(3)①在用托盤天平稱量粗產品時,如果天平的指針向右偏轉,說明粗產品質量不足
②氫氧化鈉溶液能吸收空氣中的二氧化碳;
③向A裝置中通入氣體可以將裝置中的氣體排凈,防止干擾實驗現象及結論;
④H裝置能防止空氣中的二氧化碳和水蒸氣進入G裝置,若沒有H裝置,則測定的二氧化碳值偏高,計算出的質量分數偏大;
⑤裝置D中濃鹽酸揮發出的氯化氫與裝置E中NaHCO3反應產生二氧化碳,使二氧化碳的值偏大,為了使實驗結果更準確防止干擾,可以把濃鹽酸換成稀硫酸,
(4)設碳酸鈉的質量為X
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
X 0.44克
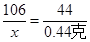
解得:X=1.06克
碳酸鈉的質量分數為:(1.06克÷20.0克)×100%=5.3%.


 名校課堂系列答案
名校課堂系列答案科目:初中化學 來源: 題型:
 某校化學課外興趣小組的同學在研究性學習課上展示了一套如下圖所示實驗裝置(假設每步化學反應都完全,氧化鐵樣品中的雜質不參加反應).查閱資料:草酸在濃硫酸存在時加熱發生如下反應:H2C2O4
某校化學課外興趣小組的同學在研究性學習課上展示了一套如下圖所示實驗裝置(假設每步化學反應都完全,氧化鐵樣品中的雜質不參加反應).查閱資料:草酸在濃硫酸存在時加熱發生如下反應:H2C2O4| 濃硫酸 | △ |
查看答案和解析>>
科目:初中化學 來源: 題型:
| ||
| △ |

| ||
| ||
查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
| ||
| ||
| ||
查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
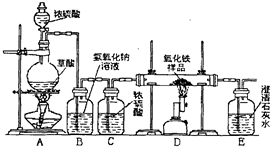 某校化學課外興趣小組的同學在研究性學習課展示了一套如圖所示的實驗裝置(假設每步化學反應都完全,氧化鐵樣品中的雜質不反應).查閱資料:草酸在濃硫酸存在時加熱發生如下反應:
某校化學課外興趣小組的同學在研究性學習課展示了一套如圖所示的實驗裝置(假設每步化學反應都完全,氧化鐵樣品中的雜質不反應).查閱資料:草酸在濃硫酸存在時加熱發生如下反應:
|
| ||
| ||
查看答案和解析>>
科目:初中化學 來源:2008年湖北省孝感市應城市初中學生化學知識競賽初賽試卷(解析版) 題型:解答題
 CO↑+CO2↑+H2O
CO↑+CO2↑+H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com