解:(1)氫氧化鈉溶液溶質的質量為:10%×500g=50g,所以溶劑水的質量為:500g-50g=450g,
由于水的密度為1g/ml,所以水的體積為450ml.故答案為:450
(2)A選項操作會使部分氫氧化鈉附著在紙上,使溶質減少,造成質量分數偏小.
B選項量水時,俯視刻度,會造成水偏少,會使質量分數偏大.
C選項會使溶劑減少,造成質量分數偏大.
故答案為:A
(3)①首先溶液變紅即可證明酚酞沒有變質,和實驗現象不符合,所以猜想不正確.
②通過實驗現象可看出由于對氫氧化鈉溶液進行了稀釋,溶液的顏色發生了改變,所以溶液的濃度與反應有關.
故答案為:①若酚酞變質,不會出現紅色;
②氫氧化鈉的濃度
(4)氫氧化鈉是一種堿可以和空氣中二氧化碳反應生成碳酸鈉和水,2NaOH+CO
2═Na
2CO
3+H
2O,所以保存時必須密封.
故答案為:2NaOH+CO
2═Na
2CO
3+H
2O;密封
(5)因為氫氧化鈉變質生成有碳酸鈉生成,所以可加入一種物質和碳酸鈉反應有現象,和氫氧化鈉沒有現象即可.
如滴加鈣離子的溶液或者鋇離子的溶液,都會出現白色沉淀.
故答案為:將氫氧化鈉溶于水,滴加氫氧化鈣溶液(或氯化鈣、氯化鋇、氫氧化鋇溶液等),有白色沉淀產生
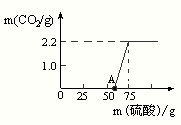
(6)解:由圖表可知反應開始消耗50ml硫酸是和氫氧化鈉反應,繼續消耗20ml硫酸是和碳酸鈉反應,且生成了二氧化碳氣體2.2g
設生成的碳酸鈉質量為x
Na
2CO
3+H
2SO
4═Na
2SO
4+H
2O+CO
2↑
106 44
x 2.2g
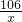
=
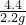
解之得:x=5.3g
所以氫氧化鈉的質量為:10.6g-5.3g=5.3g
氫氧化鈉的質量分數為:
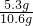
×100%=50%
答:樣品中NaOH的質量分數為50%
分析:(1)可根據溶質的質量分數的定義或公式進行求解.
(2)配制的溶液質量分數偏小,根據質量分數的定義可知有兩種情況:溶質氫氧化鈉量少或溶劑水的量偏大.
(3)結合酚酞遇堿性溶液變紅的事實和題中所給事實綜合分析解答.
(4)氫氧化鈉是一種堿可以和空氣中二氧化碳反應生成鹽和水.
(5)氫氧化鈉變質生成碳酸鈉,可根據碳酸鈉的性質和反應現象進行設計.
(6)首先分析圖表數據對應的反應,0-50ml硫酸是和氫氧化鈉反應,50-75ml硫酸是和碳酸鈉反應,生成了2.2g氣體.
點評:本考點屬于實驗探究題,既有實驗過程的探究,又有結論的探究,還有關于溶液的稀釋問題的有關計算,綜合性比較強.首先提出問題、作出假設,然后設計實驗方案、進行實驗,最后得出正確的結論,并對設計的方案進行了拓展.本考點是中考的重要內容之一,主要出現在實驗題中.

 下面是某研究性學習小組對氫氧化鈉有關性質進行探究的過程,請回答下列問題.
下面是某研究性學習小組對氫氧化鈉有關性質進行探究的過程,請回答下列問題.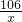 =
=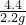
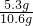 ×100%=50%
×100%=50%

 桃李文化快樂暑假武漢出版社系列答案
桃李文化快樂暑假武漢出版社系列答案 優秀生快樂假期每一天全新寒假作業本系列答案
優秀生快樂假期每一天全新寒假作業本系列答案 暑假接力賽新疆青少年出版社系列答案
暑假接力賽新疆青少年出版社系列答案
 下面是某研究性學習小組對氫氧化鈉有關性質進行探究的過程,請回答下列問題.
下面是某研究性學習小組對氫氧化鈉有關性質進行探究的過程,請回答下列問題.