
【題目】如圖所示的圖象能正確反映對應變化關系的是
A. 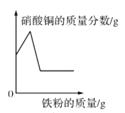 在一定量的硝酸銀和硝酸銅的混合溶液中加入鐵粉至過量
在一定量的硝酸銀和硝酸銅的混合溶液中加入鐵粉至過量
B.  向一定質量的打磨光亮的鋅片中滴加鹽酸
向一定質量的打磨光亮的鋅片中滴加鹽酸
C. 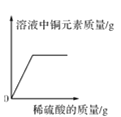 向盛有一定量氧化銅粉末的燒杯中不斷加入稀硫酸至過量
向盛有一定量氧化銅粉末的燒杯中不斷加入稀硫酸至過量
D. 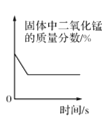 加熱一定量氯酸鉀和二氧化錳固體混合物
加熱一定量氯酸鉀和二氧化錳固體混合物
【答案】C
【解析】
A、在一定量的硝酸銀和硝酸銅的混合溶液中加入鐵粉至過量,加入的鐵粉先與硝酸銀反應,硝酸銀反應完,鐵粉再與硝酸銅反應,所以溶液中硝酸銅的質量分數先是不變,然后逐漸減小直至為零,選項錯誤;
B、向一定質量的打磨光亮的鋅片中滴加鹽酸立即反應生成氫氣,直至鋅片反應完氫氣質量不再增加,選項錯誤;
C、向盛有一定量氧化銅粉末的燒杯中不斷加入稀硫酸,氧化銅與硫酸反應生成硫酸銅和水,溶液中硫酸銅質量由零開始逐漸增大直至氧化銅完全反應,所以溶液中銅元素的質量也由零開始逐漸增大直至氧化銅完全反應,選項正確;
D、加熱一定量氯酸鉀和二氧化錳固體混合物制取氧氣,氯酸鉀分解生成氯化鉀和氧氣,固體質量減少,二氧化錳作為催化劑,質量不變,所以二氧化錳在固體中的質量分數應該是越來越大,直至氯酸鉀完全反應后不再增加,選項錯誤,故選C。


科目:初中化學 來源: 題型:
【題目】根據下列實驗裝置圖,按要求回答下列問題:
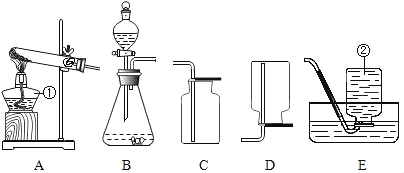
(1)寫出標號儀器的名稱:①______;②______。
(2)實驗室可用氯酸鉀和二氧化錳制取氧氣,其反應的化學方程式為______,若要收集較純凈的氧氣可選擇的收集裝置為______。
(3)實驗室制取并收集二氧化碳應選擇的裝置為______; 裝置B中用分液漏斗代替長頸漏斗的優點是
______。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】如圖為某化學反應的微觀過程,其中“![]() ”和“
”和“![]() ”表示兩種不同原子。
”表示兩種不同原子。
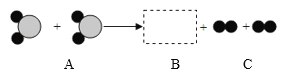
(1)A物質屬于_____(填“混合物”、“單質”或“化合物”),該反應屬于_____(填基本反應類型)反應。
(2)虛線框內應填的微觀圖示是_____(選填A、B、C、D),你推斷的依據是_____。
![]()
(3)若A、B、C為初中化學中的常見物質,寫出符合該反應的化學方程式_____
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某種手機電路板中含有Fe、Cu、Au、Ag、Ni(鎳,銀白色金屬)等金屬,如下是某工廠回收部分金屬的流程圖。已知:2Cu+O2+2H2SO4![]() 2CuSO4+2H2O
2CuSO4+2H2O
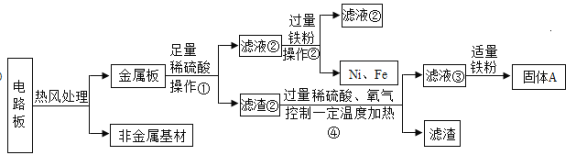
(1)操作①的名稱是____________________。
(2)寫出濾液②中金屬陽離子符號____________________。
(3)寫出濾液③和鐵粉發生反應的一個化學方程式____________________________。
(4)Cu、Ag、Ni在溶液中的活動性由強到弱的順序依次是____________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某工廠的廢水中含有MgSO4和FeCl3,技術人員逐漸加入NaOH溶液調節廢水的pH,先后分離出兩種沉淀,操作流程如圖所示。下列說法錯誤的是( )
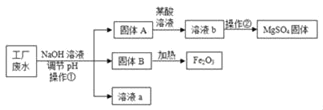
A. 固體A是Mg(OH)2
B. 操作①和②完全相同
C. 固體B加熱的產物是兩種常見氧化物,則另一種氧化物的化學式為H2O
D. 溶液a中一定含有的溶質是Na2SO4、NaCl、NaOH
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】圖中所涉及到的物質均為常見的化合物,圖中“—”表示相互反應,“→”表示轉化關系,部分反應物、生成物、反應條件已略去。其中A、B常溫下均為液態,且組成元素相同,F是大理石的主要成分,Y為氧化物,Z是紫紅色固體,L為藍色絮狀沉淀。回答下列問題:
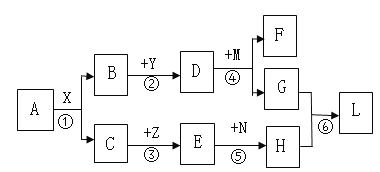
(1)寫出A物質的化學式___________。
(2)反應①—⑥涉及的基本反應類型有__________種。
(3)寫出反應④的化學方程式__________________________________。
(4)寫出N物質的一種用途_______________________________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】北京大學生命科學學院蔣爭凡教授研究組發現,錳離子是細胞內天然免疫激活劑和警報素。在元素周期表中錳元素的某些信息如圖所示,下列有關錳的說法正確的是_____。
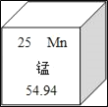
A.原子核內質子數為25
B.屬于非金屬元素
C.原子核內中子數為25
D._____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】對比實驗是科學研究中常用的方法。
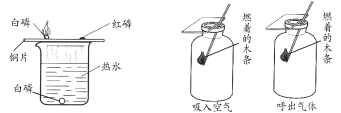
甲 乙
(1)甲實驗證明可燃物燃燒的條件之一是溫度達到著火點,依據的實驗現象是______。
(2)乙實驗的目的是比較吸入空氣和呼出氣體中______的含量。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某化學小組利用如圖所示裝置(圖中固定裝置已略去)測定銅鋅合金中鋅的質量分數,探究過程如下:
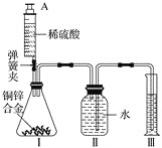
①連接實驗裝置并檢查裝置氣密性。
②向裝置Ⅰ中的錐形瓶加入2.0g的銅鋅合金樣品粉末,由注射器緩緩注入稀硫酸,待到錐形瓶中不再產生氣體時,準確讀取注射器內讀數,減少10.5mL稀硫酸,同時立即夾緊彈簧夾,移出裝置Ⅲ中的導管,準確讀取量筒內水的體積為214.0mL(注:樣品中的雜質不參加反應
③裝置Ⅰ中剩余固體物質經過適當處理后,準確稱量其質量為1.4g
④該小組的三位同學利用實驗過程測得不同數據,計算銅鋅合金樣品中鋅的質量分數
甲同學利用裝置Ⅰ中反應前后固體的質量進行計算;
乙同學利用裝置Ⅰ中加入稀硫酸的量進行計算;
丙同學利用裝置Ⅲ中量取水的體積進行計算,并查得:在標準狀況下,氫氣的密度為0.09gL-1。
回答下列問題:
(1)裝置Ⅰ中反應的化學方程式為___,實驗過程中須加入稀硫酸至不再產生氣體,目的是___。
(2)步驟③中稱量剩余固體之前的正確操作是_______、洗滌、干燥。
(3)根據實驗測定的數據,上述三位同學中________(填“甲”、“乙”或“丙”)同學無法進行計算樣品中鋅的質量分數。
(4)化學小組同學發現:按照丙同學的方案進行計算,致使實驗結果出現較大偏差。以下因素可能造成偏差的有________(填標號)。
A 移出裝置Ⅲ時,導管內留存了一部分水
B 實驗測量前,沒有排除裝置Ⅰ中的空氣
C 數據處理時,未排除加入稀硫酸所占的體積
【答案】(1)![]() ;使樣品中的鋅完全反應;(2)過濾;(3)乙;(4)AC;
;使樣品中的鋅完全反應;(2)過濾;(3)乙;(4)AC;
【解析】
試題(1)由于銅排在了氫的后面,所以與酸不反應,反應物是鋅和硫酸,生成物是硫酸鋅和氫氣,氫氣后面標上上升符號;實驗過程中須加入稀硫酸至不再產生氣體,目的是使樣品中的鋅完全反應;(2)從銅和硫酸鋅溶液的混合物中得到銅,先進行過濾,得到帶有硫酸鋅溶液的銅,再進行洗滌除去表面的硫酸鋅,再進行干燥除去水即可;(3)根據加入稀硫酸的量進行計算需要知道稀硫酸的溶質質量分數,而題中沒有告知;(4)由于鋅與硫酸反應生成硫酸鋅和氫氣時,放出熱量,如果沒等冷卻到室溫,根據熱漲冷縮的原理可知進入量筒中水偏多,所以誤認為得到的氫氣多,再就是數據處理時,未排除加入稀硫酸所占的體積,計算的結果就偏大;
考點:金屬的化學性質;化學方程式;實驗誤差分析;
點評:熟記金屬活動性順序表,知道排在氫之前的金屬和稀鹽酸或者硫酸反應生成氫氣,而排中氫之后的金屬和稀鹽酸或者稀硫酸不生成氫氣;化學反應中物質的質量比都是純凈物之間的質量比,而溶液中溶質的質量=溶液質量×溶質質量分數;本題容易出錯的地方是對實驗結果的評價,要知道鋅與硫酸反應放出熱量,會造成相應的誤差,必須冷卻到室溫才能進行觀察和計算。
【題型】實驗題
【結束】
30
【題目】用1000t含氧化鐵80%的赤鐵礦石,理論上可以煉出含鐵96%的生鐵的質量是多少?
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com