【答案】分析:原子結構中,對于一個原子,原子序數=核電荷數=核外電子數,對于陰離子,核內質子數<核外電子數,一般為非金屬原子,最外層電子多于4個,易得電子而形成陰離子;陽離子,核內質子數>核外電子數;核外電子一般最內層為2個電子,H除外,第二電子層最多一般為8個電子.
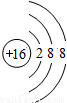
解答:解:A選項中,原子序數=核電荷數=核外電子數,故A為原子,所以A錯.
B選項中,核內質子數<核外電子數,為陰離子,所以B錯.
C選項中,核內質子數=核外電子數,為希有氣體元素的原子,所以C錯.
D選項中,核內質子數>核外電子數,為金屬元素失去電子形成的陽離子,所以D表示陽離子.
故選D.
點評:本題考查學生對原子結構示意圖及其意義的理解,以及原子和離子間的相互轉化的規律,要明確粒子中核內質子數和核外電子數之間的關系,對解決問題有所幫助.


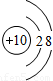
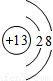


 小學奪冠AB卷系列答案
小學奪冠AB卷系列答案