
 江蘇洪澤縣順河鎮內芒硝礦是華東唯一特大芒硝礦,已探明儲量最高,且元明粉品位高、質量好,深受國內外客商青睞.元明粉是重要的化工原料,如圖是某品牌元明粉包裝袋上的部分標簽.為測定該元明粉中Na2SO4含量是否符合標簽要求,把15.0g樣品(假設只含不溶性雜質)加入一定量的水溶解,過濾得100.0g濾液.取10.0g濾液,加入10%的氯化鋇溶液20.8g,恰好完全反應.反應的化學方程式:Na2SO4+BaCl2=2NaCl+BaSO4↓.
江蘇洪澤縣順河鎮內芒硝礦是華東唯一特大芒硝礦,已探明儲量最高,且元明粉品位高、質量好,深受國內外客商青睞.元明粉是重要的化工原料,如圖是某品牌元明粉包裝袋上的部分標簽.為測定該元明粉中Na2SO4含量是否符合標簽要求,把15.0g樣品(假設只含不溶性雜質)加入一定量的水溶解,過濾得100.0g濾液.取10.0g濾液,加入10%的氯化鋇溶液20.8g,恰好完全反應.反應的化學方程式:Na2SO4+BaCl2=2NaCl+BaSO4↓.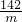 =
=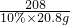
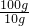 =14.2 g;
=14.2 g;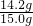 ×100%≈94.7%
×100%≈94.7% ×100%即可求得樣品中硫酸鈉的質量分數;
×100%即可求得樣品中硫酸鈉的質量分數;

科目:初中化學 來源: 題型:
 江蘇洪澤縣順河鎮內芒硝礦是華東唯一特大芒硝礦,已探明儲量最高,且元明粉品位高、質量好,深受國內外客商青睞.元明粉是重要的化工原料,如圖是某品牌元明粉包裝袋上的部分標簽.為測定該元明粉中Na2SO4含量是否符合標簽要求,把15.0g樣品(假設只含不溶性雜質)加入一定量的水溶解,過濾得100.0g濾液.取10.0g濾液,加入10%的氯化鋇溶液20.8g,恰好完全反應.反應的化學方程式:Na2SO4+BaCl2=2NaCl+BaSO4↓.
江蘇洪澤縣順河鎮內芒硝礦是華東唯一特大芒硝礦,已探明儲量最高,且元明粉品位高、質量好,深受國內外客商青睞.元明粉是重要的化工原料,如圖是某品牌元明粉包裝袋上的部分標簽.為測定該元明粉中Na2SO4含量是否符合標簽要求,把15.0g樣品(假設只含不溶性雜質)加入一定量的水溶解,過濾得100.0g濾液.取10.0g濾液,加入10%的氯化鋇溶液20.8g,恰好完全反應.反應的化學方程式:Na2SO4+BaCl2=2NaCl+BaSO4↓.查看答案和解析>>
科目:初中化學 來源:不詳 題型:問答題

查看答案和解析>>
科目:初中化學 來源:2011-2012學年江蘇省淮安市洪澤縣共和中學九年級(下)期中化學試卷(解析版) 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com