
| 實驗操作 | 實驗現(xiàn)象 | 實驗結(jié)論 |
| 取少量紅色固體加入到足量稀硫酸溶液中 | 若無明顯現(xiàn)象 | 假設(shè)1成立 |
| 若固體部分(選填“全部”或“部分”)溶解,溶液由無色變藍色 | 假設(shè)2和假設(shè)3均成立 |
分析 探究一:【猜想與假設(shè)】因為Cu和Cu2O均為不溶于水的紅色固體,則根據(jù)假設(shè)1、2,推測假設(shè)3;
【設(shè)計實驗】如果暗紅色固體中含有Cu2O,加入稀硫酸時,Cu2O和稀硫酸反應(yīng)生成硫酸銅,硫酸銅溶液是藍色的;
探究二:
【方案一】(1)考慮操作A是過濾,掌握在實驗室中完成過濾的玻璃儀器;
(2)考慮氫氧化鈉與硫酸銅溶液反應(yīng)生成藍色沉淀;
(3)根據(jù)Cu2O+H2SO4=CuSO4+Cu+H2O,通過計算,如果假設(shè)3成立,可計算紅色固體產(chǎn)物中Cu2O的含量;
【方案二】
(1)鹽酸易揮發(fā),容易揮發(fā)出氯化氫氣體;
(2)考慮濃硫酸的吸水干燥作用;
(3)裝置c中涉及的反應(yīng)為:氫氣與Cu2O生成銅與水;
(4)空氣中含有水蒸氣和二氧化碳,能夠被堿石灰吸收;
(5)正確的順序是:先連接儀器,檢查裝置的氣密性,再關(guān)閉K2,打開K1,通氫氣一段時間,把裝置中的水蒸氣和二氧化碳排出,再打開K2,關(guān)閉K1,點燃酒精燈;
(6)根據(jù)化學(xué)方程式化和質(zhì)量守恒定律,計算產(chǎn)物中Cu2O的含量;
【交流與反思】
(1)根據(jù)在方案一的測定實驗,考慮測定結(jié)果偏大的可能的原因;
(2)通過測定反應(yīng)前后c裝置的質(zhì)量也可以達到實驗?zāi)康模?/p>
解答 解:探究一:
【猜想與假設(shè)】因為Cu和Cu2O均為不溶于水的紅色固體,則根據(jù)假設(shè)1、2,推測假設(shè)3為紅色固體Cu、Cu2O的混合物;
【設(shè)計實驗】取少量暗紅色固體,加入稀硫酸,如果觀察到固體部分溶解,溶液變成藍色,即Cu2O+H2SO4=CuSO4+Cu+H2O,說明暗紅色固體含有Cu2O.
探究二:
【方案一】稱取5.00g紅色固體加入到足量稀硫酸溶液中使其充分反應(yīng)后,操作A、洗滌、干燥,稱量得紅色固體質(zhì)量為4.10g.故:
(1)操作A的名稱是 過濾,在實驗室中完成操作A的玻璃儀器有玻璃棒、燒杯和漏斗;
(2)檢驗反應(yīng)后剩余紅色固體是否洗滌干凈的方法是:取少量最后一次洗滌液,加入氫氧化鈉溶液,如果觀察到現(xiàn)象:無藍色沉淀生成,說明已洗滌干凈.
(3)設(shè)紅色固體產(chǎn)物中Cu2O的質(zhì)量為x.
根據(jù)Cu2O+H2SO4=CuSO4+Cu+H2O 質(zhì)量差
144 64 80
x 5.00g-4.20g=0.8g
則$\frac{144}{80}=\frac{x}{0.8g}$,解得x=1.44g
通過計算,假設(shè)3成立,紅色固體產(chǎn)物中Cu2O的含量為1.44g
【方案二】
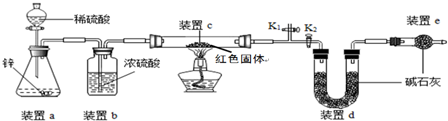
(1)裝置a中用稀硫酸而不用稀鹽酸,原因是鹽酸易揮發(fā),揮發(fā)出的氯化氫能被堿石灰吸收,影響測定結(jié)果.
(2)裝置b的作用是 干燥氫氣,若不加裝置b,實驗結(jié)果會偏大;
(3)裝置c中涉及的反應(yīng)化學(xué)方程式Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)若不加裝置e,實驗結(jié)果會偏高,原因是d中的堿石灰能夠吸收空氣中的水和二氧化碳,從而使測定的水的質(zhì)量偏高,會導(dǎo)致計算的Cu2O的質(zhì)量偏高,從而導(dǎo)致實驗結(jié)果會偏大;
(5)點燃酒精燈前涉及的部分操作如下,①連接儀器;②檢查裝置的氣密性;③關(guān)閉K2,打開K1,通氫氣一段時間以趕盡裝置內(nèi)原有的空氣,其目的是:a.防止空氣中的H2O和CO2進入裝置d干擾測定;b.防氫氣不純,發(fā)生爆炸,檢驗空氣是否趕盡的方法是:在K1處用小試管收集氣體,進行點燃實驗;④打開K2,關(guān)閉K1;
(6)經(jīng)測定反應(yīng)前后裝置d的質(zhì)量分別為100.00g、100.18g,則根據(jù)質(zhì)量守恒定律,生成水的質(zhì)量為100.18g-100.00g=0.18g,則設(shè)產(chǎn)物中Cu2O的含量為x.
Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O
144 18
x 0.18g
則$\frac{144}{x}=\frac{18}{0.18g}$,解得x=1.44g
答:產(chǎn)物中Cu2O的含量為1.44g.
【交流與反思】
(1)在方案一實驗測定中,若測定結(jié)果偏大,則下列可能的原因有:①反應(yīng)后剩余紅色固體未洗滌干凈;②洗滌后未完全干燥;③干燥方法采用的是在空氣中加熱烘干,銅與氧氣反應(yīng),使固體質(zhì)量增加.而④稱量剩余紅色固體時,有部分固體灑落到實驗臺上,結(jié)果偏小,故選①②③.
(2)還可通過測定反應(yīng)前后裝置c的質(zhì)量達到實驗?zāi)康模磻?yīng)前后裝置c的質(zhì)量差即為Cu2O中氧元素的質(zhì)量,根據(jù)氧元素的質(zhì)量可以計算Cu2O的質(zhì)量,進一步可以計算產(chǎn)物中Cu2O的含量.故填:c.
故答案為:
【猜想與假設(shè)】紅色固體Cu、Cu2O的混合物.
【實驗探究】(填寫表中空格):部分
探究二:【方案一】(1)過濾,漏斗;(2)氫氧化鈉,無藍色沉淀生成.(3)1.44g;
【方案二】(1)鹽酸揮發(fā)出氯化氫氣體,與d中的物質(zhì)反應(yīng),影響測定結(jié)果;
(2)干燥氫氣;偏大;(3)Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)防止空氣中CO2及H2O對裝置d的測量造成誤差;偏大;
(5)②檢查裝置的氣密性;③氫氣不純,發(fā)生爆炸;點燃;
(6)1.44g
【交流與反思】
(1)①②③;(2)c
點評 合理設(shè)計實驗,科學(xué)地進行實驗、分析實驗,是得出正確實驗結(jié)論的前提,因此要學(xué)會設(shè)計實驗、進行實驗、分析實驗,為學(xué)好化學(xué)知識奠定基礎(chǔ).


 數(shù)學(xué)奧賽暑假天天練南京大學(xué)出版社系列答案
數(shù)學(xué)奧賽暑假天天練南京大學(xué)出版社系列答案 南大教輔搶先起跑暑假銜接教程南京大學(xué)出版社系列答案
南大教輔搶先起跑暑假銜接教程南京大學(xué)出版社系列答案科目:初中化學(xué) 來源: 題型:選擇題
| 物質(zhì) | 氧氣 | 甲烷 | 水 | 二氧化碳 | X |
| 反應(yīng)前質(zhì)量/g | 11.2 | 3.2 | 0 | 0 | 0 |
| 反應(yīng)后質(zhì)量/g | 0 | 0 | 7.2 | 4.4 | 待測 |
| A. | 反應(yīng)類型屬于分解反應(yīng) | |
| B. | X中兩種元素的質(zhì)量比為1:1 | |
| C. | 反應(yīng)后X的質(zhì)量為3.6g | |
| D. | 反應(yīng)方程式中氧氣與水的化學(xué)計量數(shù)之比為7:8 |
查看答案和解析>>
科目:初中化學(xué) 來源: 題型:解答題
查看答案和解析>>
科目:初中化學(xué) 來源: 題型:解答題
| MgO | Mg(OH)2 | MgCO3 | |
| 消耗稀鹽酸的體積/mL | 10.4 | 7.2 | 5.0 |
查看答案和解析>>
科目:初中化學(xué) 來源: 題型:選擇題
| A. | Cu粉 Fe粉 Fe2O3粉 | |
| B. | Na2CO3 BaCl2 KNO3 | |
| C. | NaCl固體 CuSO4固體 CaCO3固體 | |
| D. | (NH4)2SO4 KNO3 NaNO3 |
查看答案和解析>>
科目:初中化學(xué) 來源: 題型:選擇題
| A. | 點燃某可燃物,在火焰上罩一個冷而干燥的燒杯,燒杯的內(nèi)壁有水霧出現(xiàn),證明可燃物一定是含有H | |
| B. | 實驗室用大理石與鹽酸反應(yīng)制取的CO2通入澄清石灰水無沉淀生成,可能是因為鹽酸太濃 | |
| C. | 某混合氣體能使灼熱的氧化銅變成紅色固體,且導(dǎo)出后氣體能使澄清石灰水變渾濁,證明原氣體中一定含有一氧化碳 | |
| D. | 含二氧化碳、一氧化碳、氫氣、水蒸氣、氮氣的混合氣體,依次通過石灰水、灼熱的氧化銅、干燥劑堿石灰(假定每步都充分吸收),最后一定只剩下氮氣 |
查看答案和解析>>
科目:初中化學(xué) 來源: 題型:解答題
| 編號 | 0.25%淀粉溶液(ml) | 蒸餾水(ml) | 0.3%NaCl溶液(ml) | 1%CuSO4溶液(ml) | 唾液溶液(ml) | 加入碘液3滴后現(xiàn)象 |
| 1 | 3 | 2 | - | - | - | 變藍色 |
| 2 | 3 | 1 | - | - | 1 | 不變藍 |
| 3 | 3 | - | 1 | - | 1 | 不變藍 |
| 4 | 3 | - | - | 1 | 1 | 變藍色 |

查看答案和解析>>
科目:初中化學(xué) 來源: 題型:選擇題
| A. | NO | B. | NO2 | C. | N2 | D. | H2 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com