
分析 (1)因為Mg的金屬活動性在(H)之前,可與稀硫酸發生置換反應,而Cu和Ag的金屬活動性在(H)之后,不能與稀硫酸發生置換反應;
(2)①根據質量守恒定律,在化學反應中,參加反應前各物質的質量總和等于反應后生成各物質的質量總和.所以生成氫氣的質量=參加反應前各物質的質量總和-反應后生成各物質的質量總和;
②根據鎂與稀硫酸反應的化學方程式和生成氫氣的質量,列出比例式,就可計算出該合金中鎂的質量和生成的溶質硫酸鋅的質量,則該合金中銅的質量=合金質量-該合金中鎂的質量;根據質量分數公式即可計算出該溶液中溶質的質量分數.
解答 解:Cu-Ag合金中的Cu和Ag都不能與稀硫酸發生置換反應,Cu-Mg合金中的Mg可與稀硫酸發生置換反應,故用稀硫酸和必要的實驗儀器就能鑒別出Cu-Mg;故答案為:①;
(1)根據質量守恒定律,產生氫氣的質量=20g+195.6g-215.2g=0.4g;由硫酸的化學式可知,所用稀硫酸中氫離子和硫酸根離子的個數比為2:1,故答案為:0.4;2:1;
(2)設生成硫酸鋅的質量為x,合金中鋅測質量為y,則
Zn+H2SO4═ZnSO4+H2↑
65 161 2
y x 0.4g
$\frac{161}{x}$=$\frac{2}{0.4g}$,解得:x=32.2g
$\frac{65}{y}$=$\frac{2}{0.4g}$,解得:y=13g
該溶液中溶質的質量分數是$\frac{32.2g}{215.2g-(20-13)g}$×100%=15.5%.
答:該溶液中溶質的質量分數是15.5%.
點評 本題主要考查學生對金屬的化學性質的認識,以及運用化學方程式和溶質質量分數公式綜合分析和解決實際問題的能力,增加了學生分析問題的思維跨度,強調了學生整合知識的能力.


 智慧小復習系列答案
智慧小復習系列答案科目:初中化學 來源: 題型:選擇題
| 物質 | 雜質 | 所選試劑 | 提純方法 | |
| A | K2SO4溶液 | KOH | 稀鹽酸 | 加入適量稀鹽酸 |
| B | NaCl溶液 | Na2SO4 | 氯化鋇溶液 | 加入適量氯化鋇溶液,過濾 |
| C | CO2 | HCl | 堿石灰 | 將混合氣體通過盛有堿石灰的裝置 |
| D | CaO | CaCO3 | 水 | 將混合物溶于水,過濾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
| 實驗操作 | 實驗現象 | 實驗結論 |
| 取少量該溶液于試管中,向溶液中滴加稀鹽酸,并不斷振蕩. | 有氣泡冒出. | 氫氧化鈉溶液一定變質了. |
| 實驗步驟 | 實驗現象 | 實驗結論 |
| (1)取少量該溶液于試管中,向溶液中滴加過量的氯化鈣溶液,并不斷振蕩. | 有白色沉淀生成. | 說明原溶液中一定有碳酸鈉. |
| (2)取步驟(1)試管中的少量上層清液,滴加酚酞溶液. | 溶液變紅色. | 說明原溶液中一定有氫氧化鈉. |
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
| 執行標準:GB1413-99 主要成分:碳酸鈣 含鈣量:每片含鈣0.75g 每瓶50片,重 40g (中外合資xx公司出品) |
| 物質的質量 | 第一次 | 第二次 | 第三次 | 平均值 |
| 反應前:燒杯+鹽酸 | 22g | 22g | 22g | 22g |
| 10片鈣片 | 8g | 8g | 8g | 8g |
| 反應后:燒杯十剩余物 | 26.7g | 26.5g | 26.9g | 26.7g |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| 選項 | 物 質 | 雜 質 | 方 法 |
| A | NaOH溶液 | Na2CO3 | 加入適量鹽酸 |
| B | CO | CO2 | 通過濃NaOH溶液 |
| C | CaCO3固體 | CaO | 高溫煅燒 |
| D | KNO3溶液 | Ba(NO3)2溶液 | 加入適量的Na2SO4溶液,過濾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. |  電解水 電解水 | |
| B. | 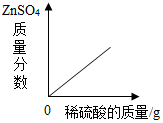 向一定量鋅粒中加入過量稀硫酸 向一定量鋅粒中加入過量稀硫酸 | |
| C. | 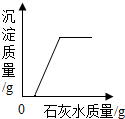 向一定量氫氧化鈉和碳酸鈉的混合溶液中加入過量的石灰水 向一定量氫氧化鈉和碳酸鈉的混合溶液中加入過量的石灰水 | |
| D. | 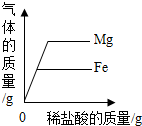 分別向等質量的鎂和鐵中滴入溶質質量分數相同的稀鹽酸至過量 分別向等質量的鎂和鐵中滴入溶質質量分數相同的稀鹽酸至過量 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com