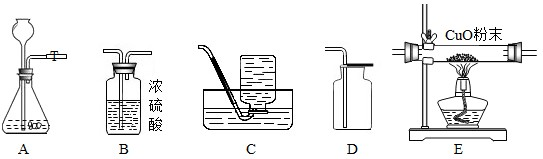
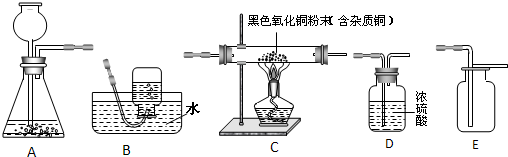
【答案】
分析:以Zn、CuO、H
2SO
4為原料,當用兩種不同的方法制備相同質量的Cu時,第一種方案:Zn+H
2SO
4=ZnSO
4+H
2↑,H
2+CuO
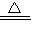
Cu+H
2O;第二種方案:CuO+H
2SO
4=CuSO
4+H
2O,CuSO
4+Zn=ZnSO
4+Cu.根據反應的物質之間的關系進行判斷,氫氣還原氧化銅,氫氣必須過量,所以要使用更多鋅和稀硫酸;制取相同質量的銅,銅只來源于氧化銅,所以消耗的氧化銅質量相等,據此進行分析解答.
解答:解:以Zn、CuO、H
2SO
4為原料,當用兩種不同的方法制備相同質量的Cu時,第一種方案:Zn+H
2SO
4=ZnSO
4+H
2↑,H
2+CuO
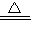
Cu+H
2O;第二種方案:CuO+H
2SO
4=CuSO
4+H
2O,CuSO
4+Zn=ZnSO
4+Cu.
A、根據氫氣還原氧化銅的實驗注意事項可知,氫氣要通入一段時間后才開始加熱;實驗完畢后,要繼續通入氫氣直至試管冷卻;則所需H
2的質量比理論值要多一些,方案一中H
2是鋅與硫酸反應生成的,故方案一消耗的鋅比方案二多;故該判斷不符合實際.
B、根據氫氣還原氧化銅的實驗注意事項可知,氫氣要通入一段時間后才開始加熱;實驗完畢后,要繼續通入氫氣直至試管冷卻;則所需H
2的質量比理論值要多一些,方案一中H
2是鋅與硫酸反應生成的,故方案一消耗的稀硫酸比方案二多;故該判斷符合實際.
C、兩種制備方案中,單質Cu中的銅元素都來自于CuO,則兩種方法消耗相等質量的CuO,故該判斷符合實際.
D、根據氫氣還原氧化銅的實驗注意事項可知,氫氣要通入一段時間后才開始加熱;實驗完畢后,要繼續通入氫氣直至試管冷卻;則所需H
2的質量比理論值要多一些,方案一中H
2是鋅與硫酸反應生成的,故方案一消耗的鋅和稀硫酸比方案二多,生成的硫酸鋅自然也比方案二多,故該判斷符合實際.
故選A.
點評:本題難度較大,掌握兩種不同的方法制備相同質量的Cu的原理、氫氣還原氧化銅的實驗注意事項、變化過程與相關量的關系等是正確解答本題的關鍵所在.

 Cu+H2O;第二種方案:CuO+H2SO4=CuSO4+H2O,CuSO4+Zn=ZnSO4+Cu.根據反應的物質之間的關系進行判斷,氫氣還原氧化銅,氫氣必須過量,所以要使用更多鋅和稀硫酸;制取相同質量的銅,銅只來源于氧化銅,所以消耗的氧化銅質量相等,據此進行分析解答.
Cu+H2O;第二種方案:CuO+H2SO4=CuSO4+H2O,CuSO4+Zn=ZnSO4+Cu.根據反應的物質之間的關系進行判斷,氫氣還原氧化銅,氫氣必須過量,所以要使用更多鋅和稀硫酸;制取相同質量的銅,銅只來源于氧化銅,所以消耗的氧化銅質量相等,據此進行分析解答. Cu+H2O;第二種方案:CuO+H2SO4=CuSO4+H2O,CuSO4+Zn=ZnSO4+Cu.
Cu+H2O;第二種方案:CuO+H2SO4=CuSO4+H2O,CuSO4+Zn=ZnSO4+Cu.

 走進文言文系列答案
走進文言文系列答案