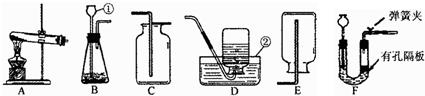
解:(1)①為長頸漏斗,②為水槽;
(2)用鋅和稀硫酸制氫氣應選擇固液常溫性發生裝置,又氫氣的密度比空氣小且難溶于水,所以發生裝置可選B或F,收集裝置可選D或E,為收集到較純凈的氫氣應選擇排水法收集.故選B、F;D.
(3)實驗室用石灰石和稀鹽酸反應生成氯化鈣、水和二氧化碳,但若用碳酸氫鈉加熱制取二氧化碳,化學反應方程式即為:2NaHCO
3
Na
2CO
3+H
2O+CO
2↑,發生裝置應選固體加熱型.
故選CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;2NaHCO
3
Na
2CO
3+H
2O+CO
2↑;A;用燃著的木條放置于瓶口,木條熄滅.
(4)用高錳酸鉀制氧氣時,為防止高錳酸鉀粉末進入導管,需在試管口放一團棉花,根據高錳酸鉀分解的化學方程式可以看出參加反應的氧原子8個,生成物中氧氣中氧原子數只有2個,所以氧原子的利用率為2÷8=25%.
故答案為:在試管口放一團膨松的棉花;25%(或1/4).
(5)高錳酸鉀完全分解后剩余物中只有二氧化錳和錳酸鉀,而二氧化錳不溶于水,錳酸鉀溶于水,所以可以利用溶解過濾的方法得到二氧化錳,然后進行洗滌干燥即可,故選Bcda.
(6)蒸發時為防止液滴向四周飛濺,所以要用玻璃棒不停的攪拌,故答案為:攪拌使液體受熱均勻,防止飛濺.
(7)用裝置F制取氣體,在反應過程中,用彈簧夾夾住導氣管上的橡皮管,氣體無法排出,裝置內氣壓變大,會把液體壓入長頸漏斗中,使固液分離反應停止.
故答案為:反應中產生的氣體使右側管內的壓強增大,使固、液分離,反應停止.
分析:①根據反應物的狀態和反應條件均可選出氫氣、氧氣、二氧化碳的發生裝置;
②二氧化碳的驗滿是用燃著的木條放在瓶口觀看木條是否熄滅的方法;
③用高錳酸鉀制取氧氣時,試管口應放一團棉花,反應過程中氧原子的利用率可根據化學方程式中氧原子的個數求出,高錳酸鉀完全分解后,要回收二氧化錳,可利用二氧化錳和錳酸鉀的溶解性不同分離混合物;
④蒸發結晶時為防止液滴向四周飛濺,可用玻璃棒攪拌;
⑤裝置F的最大優點就是能利用氣體壓強的變化使固液分離反應停止.
點評:本題綜合考查氣體的實驗室制法原理和裝置選擇,同時進行類比訓練和知識延伸,與混合物的分離聯系起來進行考查.


 Na2CO3+H2O+CO2↑,發生裝置應選固體加熱型.
Na2CO3+H2O+CO2↑,發生裝置應選固體加熱型. Na2CO3+H2O+CO2↑;A;用燃著的木條放置于瓶口,木條熄滅.
Na2CO3+H2O+CO2↑;A;用燃著的木條放置于瓶口,木條熄滅.

 閱讀快車系列答案
閱讀快車系列答案