工業上煉鐵常用的礦石有:①赤鐵礦(主要成分是)、②磁鐵礦(主要成分是Fe3O4)、③菱鐵礦(主要成分是FeCO3)、④黃鐵礦(主要成分是FeS2).
(1)這四種礦石的主要成分中,鐵的質量分數由大到小的順序是______ (填化學式).
(2)要煉出含雜質2%的生鐵2000t,至少需要含Fe3O4 75%的磁鐵礦石多少噸?(要求寫出計算過程).
解:(1)設鐵的氧化物通式為FeOx,則Fe的質量分數=
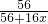
×100%,顯然x值越小,鐵的質量分數越大.將FeO、Fe
2O
3、Fe
3O
4分別變形為FeO、Fe

、Fe
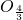
,因為1<
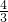
<
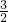
,而硫元素的相對原子質量為32,是氧元素的相對原子質量的2倍,即一個硫原子相當于兩個氧原子的質量,從而可以判斷一個FeS
2分子中相當于含有4個氧原子,結合上面的分析可以判斷故可推知答案為:FeO>Fe
3O
4>Fe
2O
3>FeS
2;
(2)生鐵中鐵的質量為2000t×(1-2%)=1960t
設需四氧化三鐵的質量為x.
4CO+Fe
3O
4
3Fe+4CO
2 232 168
x 1960t

=
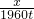
解得:x=2706.7t
需磁鐵礦的質量為2706.7t÷75%=3608.9t
答:至少需要含Fe
3O
4 75%的磁鐵礦石3608.9t.
故答案為:(1)FeO>Fe
3O
4>Fe
2O
3>FeS
2;
(2)3608.9t.
分析:(1)根據鐵礦石中的主要成分結合化合物中元素的組成及分子構成可以完成解答;
(2)由生鐵的質量和雜質的質量分數可以計算出鐵的質量;由鐵的質量根據一氧化碳與四氧化三鐵反應的化學方程式可以計算出四氧化三鐵的質量;由四氧化三鐵和磁鐵礦中四氧化三鐵的質量分數可以計算出磁鐵礦的質量.
點評:根據化學式通過計算比較鐵元素的質量分數的大小,可選擇適當的方法巧解而不是分別按常規計算,事半功倍.

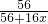 ×100%,顯然x值越小,鐵的質量分數越大.將FeO、Fe2O3、Fe3O4分別變形為FeO、Fe
×100%,顯然x值越小,鐵的質量分數越大.將FeO、Fe2O3、Fe3O4分別變形為FeO、Fe 、Fe
、Fe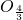 ,因為1<
,因為1<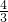 <
<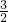 ,而硫元素的相對原子質量為32,是氧元素的相對原子質量的2倍,即一個硫原子相當于兩個氧原子的質量,從而可以判斷一個FeS2分子中相當于含有4個氧原子,結合上面的分析可以判斷故可推知答案為:FeO>Fe3O4>Fe2O3>FeS2;
,而硫元素的相對原子質量為32,是氧元素的相對原子質量的2倍,即一個硫原子相當于兩個氧原子的質量,從而可以判斷一個FeS2分子中相當于含有4個氧原子,結合上面的分析可以判斷故可推知答案為:FeO>Fe3O4>Fe2O3>FeS2; 3Fe+4CO2
3Fe+4CO2 =
=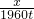


 鐵、鋁、銅是日常生活中使用最廣泛的金屬.
鐵、鋁、銅是日常生活中使用最廣泛的金屬.