
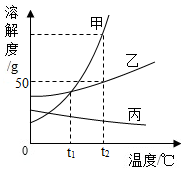
 如圖是甲、乙、丙三種固體的溶解度曲線,回答下列問題:
如圖是甲、乙、丙三種固體的溶解度曲線,回答下列問題:分析 (1)據溶解度曲線可比較同一溫度下不同物質的溶解度大小;
(2)據該 溫度下乙的溶解度分析解答;
(3)據物質的溶解度隨溫度變化情況及飽和溶液中溶質的質量分數計算方法分析解答;
(4)根據甲、乙的溶解度受溫度影響的變化規律解答;
(5)大多數物質可以采用加溶質、蒸發溶劑、降低溫度的方法,使其由不飽和溶液變為飽和溶液.
解答 解:(1)由圖可知:t2℃時,甲的溶解度 大于乙的溶解度.
(2)t2℃時乙的溶解度是50g,即100g水中最多溶解50g的乙,則向50克水中加入50g乙物質,最多溶解25g,所以充分溶解后所得溶液的質量是 75g.
(3)t1℃甲、乙、丙的飽和溶液升溫到t2℃,甲、乙溶解度變大,溶質、溶劑的質量不變,溶質的質量分數不變,與升溫前相等,丙的溶解度減小,析出晶體,則溶質的質量分數減小;據飽和溶液中溶質的質量分數=$\frac{溶解度}{100g+溶解度}$×100%,即溶解度大則溶質的質量分數大,而t1℃甲、乙的溶解度相等且大于t2℃丙的溶解度,故所得溶液中溶質質量分數的大小關系為甲=乙>丙;
(4)由于甲的溶解度隨溫度的升高而明顯增大,而乙的溶解度受溫度的影響較小,因此若固體乙中含有少量的甲,可用蒸發結晶的方法來提純乙;
(5)丙物質的溶解度隨溫度的升高而降低.即溫度越高,其溶解度越小.因此,升高溫度可以使不飽和溶液變成飽和溶液.故現有接近飽和的丙物質的溶液,欲使其變成飽和溶液,可采取的方法有:①加入丙物質;②恒溫蒸發溶劑;③升溫.
故答案為:(1)>;(2)75g;(3)甲=乙>丙;(4)蒸發結晶;(5)升高溫度.
點評 明確溶解度的概念、飽和溶液中溶解度大則溶質的質量分數大及溶解度曲線的意義,即可正確解答.掌握固體溶解度曲線的變化趨勢及其作用;掌握飽和溶液與不飽和溶液的相互轉化方法.


 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:實驗探究題
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題

查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:推斷題

查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 鼓勵火力發電 | B. | 焚燒秸稈,節約能源 | ||
| C. | 開發清潔能源 | D. | 發展露天燒烤,豐富合肥小吃文化 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com