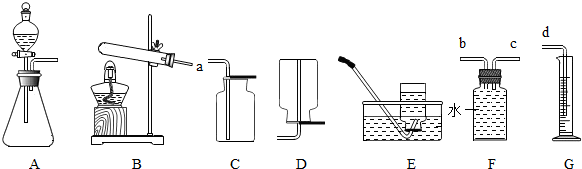
解:(1)①是試管;②是長頸漏斗;
(2)氯酸鉀在二氧化錳的催化作用下分解成氯化鉀和氧氣,反應原理為:2KClO
3
2KCl+3O
2↑;
(3)給試管中的固體加熱時試管口要略向下傾斜,防止冷凝水倒流引起試管的炸裂,因此明顯的錯誤是:試管口向上傾斜;用加熱高錳酸鉀制取氧氣的實驗,應加一團棉花防止高錳酸鉀進入導管;木炭粉還原氧化銅需要高溫,所以要提高溫度,可改用酒精噴燈加熱;
(4)大理石和稀鹽酸反應生成氯化鈣、水和二氧化碳,反應的方程式為:CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;
(5)實驗室常用塊狀固體硫化亞鐵(FeS)和稀硫酸在常溫下制取硫化氫氣體,發生裝置的特點是固液常溫型,故選擇B裝置;根據硫化氫能溶于水的性質,不能采用排水法收集;硫化氫的密度比空氣大(硫化氫的相對分子質量34>29),故采用向上排空氣法收集;因為氯化氫有毒,最好要進行尾氣處理.
故答案為:(1)試管;長頸漏斗;
(2)2KClO
3
2KCl+3O
2↑;
(3)試管口向上傾斜;試管口放一團棉花;把酒精燈換成酒精噴燈;
(4)CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;
(5)B;E.
分析:(1)熟練掌握常見的化學儀器及用途;
(2)氯酸鉀在二氧化錳的催化作用下分解成氯化鉀和氧氣;
(3)給試管中的固體加熱時試管口要略向下傾斜,防止冷凝水倒流引起試管的炸裂;若用A裝置來進行加熱高錳酸鉀制取氧氣實驗,應加棉花防止高錳酸鉀進入導管;木炭粉還原氧化銅需要高溫,所以要提高溫度,可改用酒精噴燈加熱;
(4)大理石和稀鹽酸反應生成氯化鈣、水和二氧化碳;
(5)根據反應物的狀態和反應條件確定發生裝置;根據氣體的密度和溶解性選擇收集方法.
點評:本題考查了常見氣體的制取及實驗的注意事項,關鍵是根據制取氣體時反應所使用藥品的狀態及反應的條件,確定制取氣體時應選用的發生裝置;根據氣體的密度與溶解性,確定氣體的收集方法.


 2KCl+3O2↑;
2KCl+3O2↑; 2KCl+3O2↑;
2KCl+3O2↑;