
| 實驗 序號 | 過氧化氫溶液 濃度/% | 過氧化氫溶液質量/g | 溫度/℃ | 二氧化錳用量/g | 氧氣體積/ml | 反應所需時間/s |
| ① | 5 | 12 | 20 | 0.2 | 125 | 11 |
| ② | 30 | 12 | 20 | 0.2 | 125 | 2 |
| ③ | 30 | 12 | 40 | / | 125 | 148 |
| ④ | 30 | 12 | 90 | / | 125 | 82 |
分析 (1)比較表格中的①②數據在其他條件都相同時,可以看出過氧化氫的濃度對反應速率的影響;比較表格中的③④數據在其他條件都相同時,可以看出溫度對反應速率的影響.
(2)根據實驗室操作簡便且制取氣體易收集的原則分析選擇即可.
(3)依據溶液稀釋的方法,根據稀釋前后溶質的質量不變完成.
解答 解:(1)從表中分析可知:①②是過氧化氫濃度不同而其他的反應時各種量均相同,可知這一過程是考查反應物的濃度與反應速度的關系,且過氧化氫溶液的濃度越大,反應速率越快;
③④則是溫度不同其他條件相同,明顯是對溫度影響化學反應速度的探究;從結果看溫度高時反應所用的時間較短,既反應的速度較快,溫度低時反應的速度慢.
(2)實驗室用過氧化氫制取氧氣要求反應簡便易操作,所以采用不加熱而加催化劑的方法進行較合適,從易于收集的角度反應的速度不能太快也不能太慢,所以最合適的條件是20℃時5%過氧化氫溶液中加入少量二氧化錳;
(3)設利用配置450克5%的過氧化氫溶液所需的30%的過氧化氫溶液質量是x.
450g×5%=x×30%
x=75g
所以加水的質量是450g-75g=375g
配置的過程是往一定量30%的過氧化氫溶液中加入375g克水,然后用玻璃棒攪拌均勻即可,還需要玻璃儀器有量筒、燒杯;
故答案為:(1)①溫度:其他條件相同時,溫度越高反應速率越快.
②濃度:其他條件相同時,濃度越高反應速率越快.
③催化劑:該反應用二氧化錳作催化劑能大大加快反應速率
(2)20℃時5%過氧化氫溶液中加入少量二氧化錳;(3)375;量筒、燒杯;
點評 本題主要考查了能夠影響化學反應的因素,解答這類題時要注意盡可能的把題中的能夠影響化學反應的因素找出,然后再利用控制變量法來進行判斷,最后得出答案.


 中考解讀考點精練系列答案
中考解讀考點精練系列答案科目:初中化學 來源: 題型:解答題
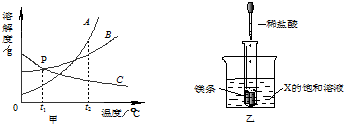
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 第一次反應停止后,B剩余18克 | B. | 反應中A和C的質量比為5:3 | ||
| C. | 反應中A和B的質量比為3:2D | D. | 第二次反應后,D的質量為100克 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題

查看答案和解析>>
科目:初中化學 來源: 題型:解答題
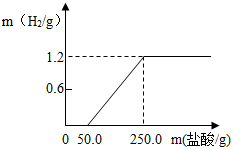 某興趣小組從廢鋁鍋底部剪一塊鋁片,將它放入21.9%的稀鹽酸中,產生氫氣的質量與消耗鹽酸的質量如圖(假設酸與氧化膜反應時沒有H2產生,其它雜質不與酸反應).請回答:
某興趣小組從廢鋁鍋底部剪一塊鋁片,將它放入21.9%的稀鹽酸中,產生氫氣的質量與消耗鹽酸的質量如圖(假設酸與氧化膜反應時沒有H2產生,其它雜質不與酸反應).請回答:查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 合金含兩種或兩種以上金屬 | |
| B. | 含有氧元素的化合物都屬于氧化物 | |
| C. | 酸堿中和生成鹽和水,所以鹽溶液都為中性 | |
| D. | 若使可燃物的溫度降到著火點以下就能滅火 |
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com