
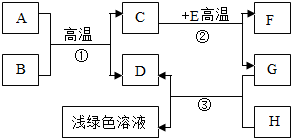
 A-H是初中化學學習中常見的物質.其中A是天然氣的主要成分,B是最常見的溶劑,D、G是單質,C、D、F均是氣體.它們之間的轉化如右圖所示.
A-H是初中化學學習中常見的物質.其中A是天然氣的主要成分,B是最常見的溶劑,D、G是單質,C、D、F均是氣體.它們之間的轉化如右圖所示. 2Fe+3CO2
2Fe+3CO2 2Fe+3CO2
2Fe+3CO2 2Fe+3CO2
2Fe+3CO2 

 第三學期贏在暑假系列答案
第三學期贏在暑假系列答案 學練快車道快樂假期暑假作業新疆人民出版社系列答案
學練快車道快樂假期暑假作業新疆人民出版社系列答案科目:初中化學 來源: 題型:
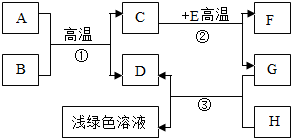 A-H是初中化學學習中常見的物質.其中A是天然氣的主要成分,B是最常見的溶劑,D、G是單質,C、D、F均是氣體.它們之間的轉化如右圖所示.
A-H是初中化學學習中常見的物質.其中A是天然氣的主要成分,B是最常見的溶劑,D、G是單質,C、D、F均是氣體.它們之間的轉化如右圖所示.查看答案和解析>>
科目:初中化學 來源: 題型:
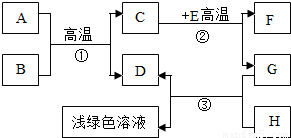
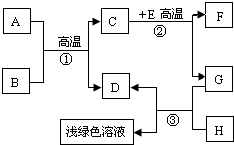 A-H是初中化學學習中常見的物質.其中A是天然氣的主要成分,B是最常見的溶劑,D、G是單質,C、D、F均是氣體.它們之間的轉化如圖所示.回答下列問題:
A-H是初中化學學習中常見的物質.其中A是天然氣的主要成分,B是最常見的溶劑,D、G是單質,C、D、F均是氣體.它們之間的轉化如圖所示.回答下列問題:查看答案和解析>>
科目:初中化學 來源:2011年江蘇省常州市北環中學九年級新課結束考試化學試卷(4月份)(解析版) 題型:解答題
查看答案和解析>>
科目:初中化學 來源:2011年廣東省佛山市禪城區中考化學科研試卷(二)(解析版) 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com