
以下是從元素周期表中截取的四種元素的信息,請回答下列問題:
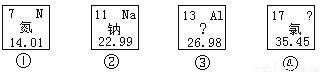
(1)①元素原子的相對原子質量是 ;
(2)③元素的一種微粒的結構示意圖為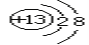 它屬于 (填“金屬元素”或“非金屬元素”或“稀有氣體元素”),該微粒的符號為 ;
它屬于 (填“金屬元素”或“非金屬元素”或“稀有氣體元素”),該微粒的符號為 ;
(3)由②與④形成化合物的化學式是 。
(1)14.01;(2)金屬元素;Al3+(3)NaCl; 【解析】 試題分析:(1)元素單元格正下方“14.01”為相對原子質量;(2)由偏旁“钅”屬于金屬元素;失去了3個電子,為帶3個正電荷的陽離子Al3+(3)鈉顯+1價,氯顯-1價,由化學式寫法NaCl; 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源:重慶市(江津二中等)八校2018屆九年級下學期第一階段考試化學試卷 題型:單選題
“金銀銅鐵錫”俗稱五金,在這五種金屬中,金屬活動性最強的是( )
A. 金 B. 銀 C. 銅 D. 鐵
D 【解析】金屬活動順序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金屬活動順序表中,排在氫前邊的金屬能和酸發生置換反應生成鹽和氫氣。金屬的位置越靠前,金屬的活動性越強。選D查看答案和解析>>
科目:初中化學 來源:河北省2018屆九年級上學期期中考試化學試卷 題型:單選題
垃圾分類回收對資源的充分利用及環境保護有重要意義.下列對垃圾的處理方法中不合理的是( )
A. 將回收的廢舊電池單獨存放
B. 將回收的廢舊報紙制成鉛筆桿
C. 用電磁鐵將金屬制品分離出來
D. 焚燒垃圾用來發電
C 【解析】A、廢舊電池中含有汞等重金屬,隨便存放會污染水體和土壤,所以要單獨存放,故A不合題意. B、鉛筆桿和報紙成份都是纖維,這樣節省能源,所以B不合題意. C、金屬制品并不是單一金屬,并且并不是金屬都有磁性,所以利用電磁鐵分離金屬制品不對.故C符合題意. D、用垃圾產生的熱量發電有利于節能環保.故D不合題意. 故選C.查看答案和解析>>
科目:初中化學 來源:江蘇省實驗學校2018屆九年級下學期第一次月考化學試卷 題型:單選題
下列化學實驗基本操作錯誤的是
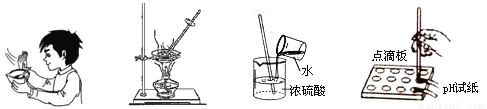
A.研磨聞氣味 B.蒸發食鹽水 C.稀釋濃硫酸 D.測溶液的pH
C 【解析】 試題分析: A.聞氣體的氣味時,用手輕輕在瓶口扇動,僅使極少量的氣體飄進鼻孔,故正確;B.蒸發過程中必須用玻璃棒不斷攪拌,以防止局部溫度過高而使液體飛濺,故正確;C.稀釋濃硫酸時,沿燒杯內壁將濃硫酸緩緩加入水中,邊加邊攪拌,故錯誤;D.測定溶液酸堿度時應用玻璃棒蘸取待測溶液,滴在試紙上,不能直接將試紙伸入液體中,故正確.查看答案和解析>>
科目:初中化學 來源:福建省漳州市2017-2018學年九年級第一輪總復習化學試卷 題型:計算題
鈣是人體必須的常量元素,每日必須攝入足夠量的鈣.目前市場上的補鈣藥劑很多,如圖是某種品牌的補鈣藥品的部分說明書.

請回答下列問題:
(1)CaCO3中鈣元素的質量分數為_____;
(2)若每片鈣片的質量為1g,則鈣片中鈣元素的質量分數為_____;
(3)如果按用量服用,每天攝入鈣元素的質量為_______克(寫出計算過程).
40% 25% 0.5g 【解析】(1)CaCO3中鈣元素的質量分數為×100%=40%;(2)每片含CaCO3的質量為0.5g,含鈣元素的質量為:0.625g×40%=0.25g;每片鈣片的質量為1g,則鈣片中鈣元素的質量分數為×100%=25%;(3)根據題意,每次服用一片,每天2次,每片鈣片的質量為1g,則每天服用鈣片的質量為1g×2=2g,其中含鈣元素的質量為2g×25%=0.5g。...查看答案和解析>>
科目:初中化學 來源:福建省漳州市2017-2018學年九年級第一輪總復習化學試卷 題型:單選題
下列各方程式中,書寫正確是:( )
A.P+O2↑ PO2
PO2
B.4Fe+3O2 2Fe2O3
2Fe2O3
C.CH4+2O2 CO2+2H2O
CO2+2H2O
D.C+2CuO 2Cu+CO2
2Cu+CO2
查看答案和解析>>
科目:初中化學 來源:福建省漳州市2017-2018學年九年級第一輪總復習化學試卷 題型:單選題
已知某巖石(鉀長石)的化學式為:KAlSi3O8,則該巖石中硅元素的化合價為( )
A. +2 B. +3 C. +4 D. +6
C 【解析】試題分析:(鉀長石)的化學式為:KAlSi3O8,則設該巖石中硅元素的化合價為X,+1++3+3X+(-2)*8=0,則X=+4.故選C.查看答案和解析>>
科目:初中化學 來源:江蘇省2018屆九年級下學期第一次月考化學試卷 題型:單選題
能在pH=11的溶液中大量共存,且溶液為無色透明的一組物質是 ( )
A. AlCl3、CuSO4、NaCl B. BaCl2、NaCl、NaOH
C. CaCl2、Na2CO3、AgNO3 D. K2SO4、NaNO3、NH4Cl
B 【解析】pH=11的溶液呈堿性。A. AlCl3、CuSO4 溶液呈藍色、NaCl 。B. BaCl2、NaCl、NaOH。能在pH=11的溶液中大量共存,且溶液為無色透明的。C. CaCl2和Na2CO3 反應生成碳酸鈣沉淀、和AgNO3 反應生成氯化銀沉淀。D. K2SO4、NaNO3、NH4Cl在堿性溶液中,生成氨氣。 點睛∶本題主要考查復分解反應的條件。查看答案和解析>>
科目:初中化學 來源:四川省岳池縣2018屆九年級階段檢測(二)化學試卷 題型:填空題
學習了鹽酸的性質后,小軍歸納出鹽酸的五條化學性質(如圖)。
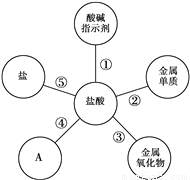
(1)為了驗證性質①,小軍將紫色石蕊溶液滴加到鹽酸溶液中,溶液變______色;
(2)圖中A所表示的物質類別是___________;試寫出一個鹽酸與該類別物質發生反應的化學方程式__________________________;
(3)為了驗證性質⑤,可選用的物質是_______(填一種即可);
(4)鎂和鋅可以用來驗證鹽酸的性質②。現在小軍要探究鎂和鋅與鹽酸反應的快慢,下列因素不影響鎂和鋅與鹽酸反應快慢的是_______(填序號);
A.鹽酸的質量分數 B.溫度
C.反應容器的大小 D.兩種金屬的形狀
寫出鋅與鹽酸發生反應的化學方程式_________________。
紅 堿, NaOH+HCl==NaCl+H2O(符合條件即可); 符合條件的鹽即可; C Zn + 2HCl == ZnCl2 + H2↑ 【解析】(1)紫色石蕊溶液遇鹽酸變紅。(2)鹽酸有五條化學性質:與指示劑反應、與金屬單質反應、與金屬氧化物反應、與堿反應、與鹽反應,故填堿。酸堿反應生成鹽和水。(3)實驗室可用稀鹽酸與大理石(大理石主要成分是碳酸鈣)反應來制取二氧化碳,CaCO3 + 2...查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com