
【題目】人類歷史發展的不同階段曾以不同金屬材料的使用作為標志。

(1)金、銀在自然界有單質形式存在,說明它們的化學性質_____;
(2)在生產生活實踐中,人類逐漸掌握了多種金屬的冶煉技術。
①比較兩種鐵礦石:磁鐵礦(主要成分 Fe3O4)和菱鐵礦(主要成分 FeCO3),從化學的角度分析“磁鐵礦作煉鐵原料更具優勢”,其原因是______;
②鋁制品應用廣泛,不易被腐蝕,是因為______(用化學方程式來表示);
(3)鎂鋁合金被譽為“21 世紀綠色金屬結構材料”。一種鎂鋁合金 Mg17All2 是特殊的儲氫材料,完全吸收氫氣后得到 MgH2 和 Al,該反應的化學方程式為_____;
(4)鈦和鈦合金是 21 世紀的重要的金屬材料。鈦合金制品放在海水中數年,取出后仍光亮如新,是因為其_____(填字母序號)非常好;
A 可塑性 B 機械性能 C 抗腐蝕性能
(5)鐵在潮濕的空氣中易生成疏松的鐵銹。已知:2FeCl3+Fe=3FeCl2
①鐵銹的主要成分是________(填化學式),將生銹的鐵制品放入一定量的稀鹽酸中充分反應,變化過程中最多涉及______種化學反應基本類型;
②將 10g 表面生銹的鐵釘(雜質已忽略)浸泡在 100g 溶質質量分數為 7.3%的稀鹽酸中充分反應,觀察到鐵銹已完全消失。反應停止后,取出光亮的鐵釘洗滌、干燥、稱量,質量為 3.6g。則原生銹鐵釘中鐵元素的質量分數為______;
(6)利用“活潑金屬”可以制得 H2 用作汽車能源。若推廣應用于汽車產業,則需綜合考慮的因素有________ (填字母序號)。
A 金屬原料的成本 B 生成過程中的能耗和污染 C 金屬的回收利用
【答案】穩定 磁鐵礦含鐵量高于菱鐵礦 4Al+3O2=2Al2O3 Mg17All2+17H2=17MgH2+12Al C Fe2O3 3 92% ABC
【解析】
(1)金、銀在自然界有單質形式存在,說明它們的化學性質都不活潑;
(2)①在Fe3O4中鐵元素的質量分數=![]() ,在FeCO3中鐵元素的質量分數=
,在FeCO3中鐵元素的質量分數=![]() ,從化學的角度分析“磁鐵礦作煉鐵原料更具優勢”,其原因是磁鐵礦含鐵量高于菱鐵礦;
,從化學的角度分析“磁鐵礦作煉鐵原料更具優勢”,其原因是磁鐵礦含鐵量高于菱鐵礦;
②鋁制品應用廣泛,不易被腐蝕,是因為鋁在空氣易形成致密而堅實氧化鋁氧化膜,阻止反應進一步進行,反應的化學方程式為:4Al+3O2=2Al2O3;
(3)該反應的反應物是Mg17Al12和H2,生成物是MgH2和Al,化學方程式為:Mg17All2+17H2=17MgH2+12Al;
(4)由于鈦合金抗腐蝕性能非常好,所以鈦合金制品放在海水中數年,取出后仍光亮如新,故選C;
(5)①鐵銹的主要成分是Fe2O3;將生銹的鐵制品放入一定量的稀鹽酸中充分反應,變化過程中發生的反應有:Fe2O3+6HCl=2FeCl3+3H2O,該反應是兩種化合物相互交換成分生成兩種化合物的反應,屬于復分解反應;Fe + 2HCl = FeCl2 + H2↑,該反應是由一種單質與一種化合物生成另一種單質和另一種化合物的反應,屬于置換反應:2FeCl3+Fe=3FeCl2,該反應是由兩種物質生成一種化合物的反應,屬于化合反應。變化過程中最多涉及三種化學反應基本類型;
②充分反應后都生成了FeCl2,根據質量守恒定律可知,FeCl2中的氯元素全部來自于鹽酸,設FeCl2中鐵元素的質量為x,則有:
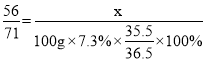 ,x=5.6;
,x=5.6;
原銹鐵釘中鐵元素的質量分數=![]() ;
;
(6)利用“活潑金屬”可以制得H2,H2可用作汽車能源。若推廣應用于汽車產業,則需綜合考慮的因素有金屬原料價格是否便宜、生成過程中的能耗和污染是否大、金屬是否便于回收和利用等,故選ABC。


 第1卷單元月考期中期末系列答案
第1卷單元月考期中期末系列答案科目:初中化學 來源: 題型:
【題目】小兵和小東是某校化學研究性學習小組的成員,他們在查閱資料時,發現單質碳能夠在高溫時與金屬氧化物反應得到金屬單質。于是,他們用木炭與CuO進行了如下的探究活動。請你參與他們的這次活動,并解決有關問題。
(提出問題)木炭與氧化銅反應除生成單質銅外,另一種生成物是什么?
(猜想與假設)猜想一:可能是CO;猜想二:可能是CO2。
(設計實驗方案)
(1)檢驗CO2的方法是__________(用化學方程式表示)。
(2)為了檢驗CO,他們設計的方案是:把小動物放在收集的氣體中,觀察能否存活。后經充分研究,認為此方案不能說明問題,其理由是____________
(查閱資料)他們在互聯網上收集到這樣一條信息:把濾紙浸泡在磷鉬酸和氯化鈀的黃色混合溶液中制成的試紙遇CO立即變成藍色,而遇CO2不變色。
(實驗與結論)設計的實驗裝置圖如下圖所示,請完成下邊的表格。
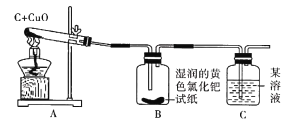
實驗現象 | 實驗結論 |
A中固體由黑色變成紅色 | 有金屬銅生成 |
B中黃色試紙沒有變藍 | 沒有______生成 |
C中_________ | 有CO2生成 |
(反思與評價)如果A裝置中的試管口高于試管底部,在實驗過程中可能造成的后果是_____。
(注意:若答對第(3)小題獎勵2分,化學試卷總分不超過40分。)
(3)對下列三種氧化銅和碳的質量比例,你建議選擇_______(填序號)的比例。
A 38:3 B 40:3 C 42:3
你這樣選擇的理由是__________
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下圖是X、Y兩種固體物質的溶解度曲線。下列敘述正確的是
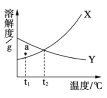
A. 溫度低于t2℃時,物質Y的溶解度小于X
B. X、Y的溶解度都隨溫度升高而增大
C. a點表示t1℃時X、Y的溶液都、不飽和
D. Y的飽和溶液降低溫度后,溶質質量分數不變
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】甲、乙、丙三種物質分別是高爐煉鐵三種原料的主要成分,A~J 是初中化學常見的物質, 它們有如下轉化關系(部分反應的生成物和反應條件已略去)。已知 B 在大氣中的存在產生了溫室應,H是通常狀況下密度最小的氣體,D 和 G 可以發生中和反應。

請回答下列問題:
(1)寫出化學式: 甲______________, B______________;
(2)寫出符合要求的化學方程式:
反應② ___________________,
反應③_____________________;
(3)在上述轉化中,I 和 J 兩種物質的組成元素相同,且反應⑤屬于化合反應,則反應⑤的化學方程式為____________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下列圖象反映的變化規律與其對應操作不相符的是
A. 向氯化鈉的飽和溶液中加入氯化鉀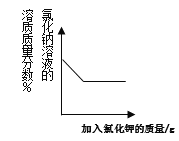
B. 向灼熱的赤鐵礦中通入CO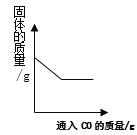
C. 向等質量的Al和Mg中加入足量的等質量等溶質質量分數的稀鹽酸
D. 將飽和的氯化鈉溶液恒溫蒸發水
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】酸、堿、鹽在生產、生活中有廣泛的應用。
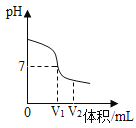
(1)氫氧化鈉溶液與稀硫酸反應時,溶液pH變化如圖所示。
①根據圖示判斷該實驗是將__________滴入到___________中。
②滴入溶液體積為V2mL時,溶液中溶質為________________(填化學式)。
(2)測定某酸溶液pH時,如果放pH試紙的玻璃片上的水沒有擦干就進行測定,會使測得的pH________(填“偏大”或“偏小”)
(3)本實驗要將80g10%的氫氧化鈉溶液恰好完全反應,需要一定質量,一定質量分數的硫酸溶液;如果改為等質量,等質量分數的鹽酸與該氫氧化鈉溶液反應,則反應完滴加幾滴紫色石蕊溶液后呈__________色。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】從海水中制備純堿和金屬鎂的流程如下圖所示:
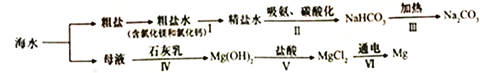
下列說法錯誤的是
A. 流程I依次向粗鹽水中加入過量Ca(OH)2溶液、Na2CO3溶液和適量稀鹽酸去除雜質
B. 流程II吸氨是使溶液呈堿性,有利于吸收二氧化碳
C. 上述流程涉及到三種基本反應類型
D. 流程IV、V是通過化學方法富集氯化鎂
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】根據如圖回答問題:
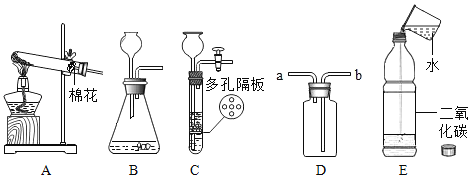
(1)請指出上述制取氣體的發生裝置中存在的一處錯誤是______,改正后用于實驗室制取氧氣,發生反應的化學方程式是___________ 。
(2)實驗室用裝置 C 制取二氧化碳的優點是___________。
(3)如圖 E 裝置,裝滿二氧化碳的塑料瓶中加入少量水后,蓋緊瓶塞震蕩,觀察到瓶子變癟,此現象_____(選填“能”或“不能”)證明二氧化碳與水發生了反應。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】向200gAgNO3溶液中加入m克Fe和Cu的混合粉末,攪拌,充分反應后過濾、洗滌、干燥得21.6g固體。向濾液中滴加NaCl溶液,產生白色沉淀。下列說法正確的是( )
A.濾液的質量是178.4g
B.混合粉末的質量范圍是5.6g<m<6.4g
C.固體中加入稀鹽酸可能會有氣體生成
D.原AgNO3溶液的溶質質量分數是17%
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com