
 小芳在實驗室用石灰石和稀鹽酸制取了二氧化碳,并對實驗產生的廢液進行溶質成分鑒定:取廢液上層清液50克,滴加質量分數為26.5%的碳酸鈉溶液,出現氣泡,滴加至10克開始出現白色沉淀,繼續滴加至沉淀不再產生,過濾,洗滌,干燥,稱得沉淀質量為5克,并繪制了圖象,如圖:
小芳在實驗室用石灰石和稀鹽酸制取了二氧化碳,并對實驗產生的廢液進行溶質成分鑒定:取廢液上層清液50克,滴加質量分數為26.5%的碳酸鈉溶液,出現氣泡,滴加至10克開始出現白色沉淀,繼續滴加至沉淀不再產生,過濾,洗滌,干燥,稱得沉淀質量為5克,并繪制了圖象,如圖: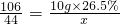 x=1.1g.
x=1.1g.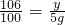 y=5.3g
y=5.3g

科目:初中化學 來源: 題型:

查看答案和解析>>
科目:初中化學 來源: 題型:

| ||
| ||
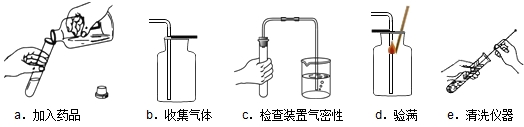
查看答案和解析>>
科目:初中化學 來源: 題型:
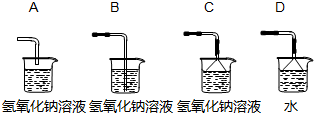
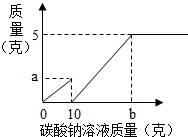 小芳在實驗室用石灰石和稀鹽酸制取了二氧化碳,并對實驗產生的廢液進行溶質成分鑒定:取廢液上層清液50克,滴加質量分數為26.5%的碳酸鈉溶液,出現氣泡,滴加至10克開始出現白色沉淀,繼續滴加至沉淀不再產生,過濾,洗滌,干燥,稱得沉淀質量為5克,并繪制了圖象,如圖:
小芳在實驗室用石灰石和稀鹽酸制取了二氧化碳,并對實驗產生的廢液進行溶質成分鑒定:取廢液上層清液50克,滴加質量分數為26.5%的碳酸鈉溶液,出現氣泡,滴加至10克開始出現白色沉淀,繼續滴加至沉淀不再產生,過濾,洗滌,干燥,稱得沉淀質量為5克,并繪制了圖象,如圖:查看答案和解析>>
科目:初中化學 來源: 題型:解答題


查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com