
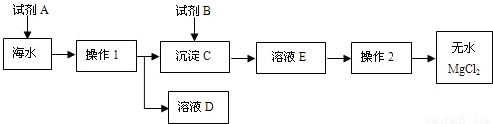
 CaO+CO2↑;CaO+H2O=Ca(OH)2;MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
CaO+CO2↑;CaO+H2O=Ca(OH)2;MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2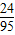 ×100%,所以12克的鎂需要在47.5克的氯化鎂中,故答案為:47.5
×100%,所以12克的鎂需要在47.5克的氯化鎂中,故答案為:47.5

 舉一反三單元同步過關卷系列答案
舉一反三單元同步過關卷系列答案科目:初中化學 來源:2010年山東省濰坊市諸城市中考考前模擬化學試卷(三)(解析版) 題型:選擇題
查看答案和解析>>
科目:初中化學 來源:2009年廣東省廣州市海珠區中考化學二模試卷(解析版) 題型:解答題
| 實驗步驟 | 實驗現象與結論 |
查看答案和解析>>
科目:初中化學 來源:2009年廣東省廣州市海珠區中考化學二模試卷(解析版) 題型:解答題

查看答案和解析>>
科目:初中化學 來源:2009年廣東省廣州市海珠區中考化學二模試卷(解析版) 題型:解答題

查看答案和解析>>
科目:初中化學 來源:2009年廣東省廣州市海珠區中考化學二模試卷(解析版) 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com