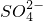某氯化鉀含有少量的氯化鋇.現稱取此固體混合物12.93克置于燒杯中,再逐步加入溶質質量分數為5%的K2SO4溶液34.80克,攪拌,恰好完全反應.在室溫(20℃)下過濾,得濾液和濾渣.已知20℃時,KCl的溶解度為34.0克.求:
(1)濾液的溶質質量分數;
(2)濾渣的質量.(計算結果保留兩位小數.)
分析:根據題目中的反應物、生成物和反應條件,依據化學方程式的書寫方法,可以寫出氯化鋇與K
2SO
4反應的化學方程式;根據化學方程式找出K
2SO
4溶與BaCl
2、BaSO
4、KCl的質量比,由K
2SO
4的質量可計算出BaCl
2、BaSO
4、KCl的質量.
(1)根據溶質質量分數公式:溶質質量分數=
×100%,來計算濾液的溶質質量分數;
(2)濾渣的質量=BaSO
4的質量+未溶解的KCl的質量.
解答:解:設固體混合物中含BaCl
2質量為xg,則KCl質量為(12.93-x)g,BaCl
2與K
2SO
4反應生成BaSO
4質量為yg,生成KCl質量為zg.
BaCl
2+K
2SO
4═BaSO
4↓+2KCl
208 174 233 74.5×2
x克 34.80×5%g yg zg
則
=,解得x=2.08,
=,解得y=2.33;
=,解得z=1.49;
但KCl總質量為(12.93-2.08)克+1.49克=12.34克
故知KCl未溶解完,余12.34克-11.24克=1.10克
故所得濾液為20℃時的飽和溶液
(1)濾液中溶質質量分數:
×100%=25.37%
(2)濾渣質量:2.33克+1.10克=3.43克
答:(1)濾液的溶質質量分數是25.37%;
(2)濾渣的質量是3.43克.
點評:本題主要考查化學方程式的書寫和有關化學方程式的計算.在計算(2)時注意,濾渣的質量由兩部分組成:氯化鋇與硫酸鉀反應生成的硫酸鋇沉淀和為溶解的氯化鉀的質量.