
如圖為某實驗室盛放稀鹽酸試劑瓶,為測定其質量分數,取6g溶液于試管中,向其中逐滴滴加10%的氫氧化鈉溶液,用pH試紙不斷測量溶液的酸堿度,當滴加至4g時,溶液pH值恰好為7.
(1)用pH試紙測定溶液的酸堿度的具體方法是 .
(2)試計算:
①稀鹽酸的質量分數.
②試管中所得溶液的質量分數.(測定溶液的酸堿度造成的溶液質量損失忽略不計,計算結果精確至1%)
(1)用玻璃棒蘸取溶液滴到pH試紙上,然后將顯示的顏色與標準比色卡比較得到溶液的pH值
(2)①6% ②6%
【解析】
試題分析:(1)根據測定溶液酸堿度的方法進行解答;
(2)依據鹽酸和氫氧化鈉溶液恰好反應時溶液的pH值為7,此時反應的氫氧化鈉溶液的質量是4g,據此計算氫氧化鈉的質量,依據方程式計算鹽酸、氯化鈉的質量,并計算溶液溶質的質量分數.
解:(1)用pH試紙測定溶液的酸堿度的具體方法是:用玻璃棒蘸取溶液滴到pH試紙上,然后將顯示的顏色與標準比色卡比較得到溶液的pH值;
故答案為:用玻璃棒蘸取溶液滴到pH試紙上,然后將顯示的顏色與標準比色卡比較得到溶液的pH值;
(2)鹽酸和氫氧化鈉溶液恰好反應時氫氧化鈉的質量是:4g×10%=0.4g
設所取稀鹽酸中溶質的質量是x,生成氯化鈉的質量是y
HCl+NaOH═NaCl+H2O
36.5 40 58.5
x 0.4g y
 =
=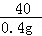
x=0.365g
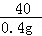 =
=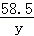
y=0.585g
∴該鹽酸溶質質量分數為: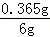 ×100%≈6%;
×100%≈6%;
試管中所得溶液的質量分數為: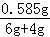 ×100%≈6%
×100%≈6%
答:稀鹽酸的質量分數約是6%,試管中所得溶液的質量分數約是6%.
考點:根據化學反應方程式的計算;溶液的酸堿度測定;有關溶質質量分數的簡單計算.
點評:酸和堿恰好反應時溶液的pH值恰好為7,據此結合題目所給數據及方程式進行解答.


科目:初中化學 來源: 題型:
 如圖為某實驗室盛放稀鹽酸試劑瓶,為測定其質量分數,取6g溶液于試管中,向其中逐滴滴加10%的氫氧化鈉溶液,用pH試紙不斷測量溶液的酸堿度,當滴加至4g時,溶液pH值恰好為7.
如圖為某實驗室盛放稀鹽酸試劑瓶,為測定其質量分數,取6g溶液于試管中,向其中逐滴滴加10%的氫氧化鈉溶液,用pH試紙不斷測量溶液的酸堿度,當滴加至4g時,溶液pH值恰好為7.查看答案和解析>>
科目:初中化學 來源: 題型:解答題
 如圖為某實驗室盛放稀鹽酸試劑瓶,為測定其質量分數,取6g溶液于試管中,向其中逐滴滴加10%的氫氧化鈉溶液,用pH試紙不斷測量溶液的酸堿度,當滴加至4g時,溶液pH值恰好為7.
如圖為某實驗室盛放稀鹽酸試劑瓶,為測定其質量分數,取6g溶液于試管中,向其中逐滴滴加10%的氫氧化鈉溶液,用pH試紙不斷測量溶液的酸堿度,當滴加至4g時,溶液pH值恰好為7.查看答案和解析>>
科目:初中化學 來源:不詳 題型:問答題
查看答案和解析>>
科目:初中化學 來源:2012-2013學年山東省濟南市天橋區九年級(上)期末化學試卷(解析版) 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com