
分析 根據三種金屬的活動性由強到弱的順序:鋅>銅>銀,依據實驗現象“得到藍色溶液”,判斷銅、鋅混合物與硝酸銀充分反應的結果分析濾渣和濾液的成分;根據濾液滴加稀鹽酸,有白色沉淀生成,說明有硝酸銀,據此分析濾液中的溶質.
解答 解:(1)由得到溶液呈藍色,說明銅粉與硝酸銀發生了反應,反應后溶液中一定含有硝酸銅;由于鋅的活動性比銅強,鋅會先于銅與硝酸銀反應且鋅粉可與硝酸銅反應,因此可判斷鋅粉已完全反應,溶液中一定含有硝酸鋅;硝酸銀是否完全反應則成為所要猜測的兩種可能,若硝酸銀完全反應,則溶液中只含有硝酸鋅、硝酸銅,若硝酸銀有剩余,則溶液中含有硝酸鋅、硝酸銅、硝酸銀;因此濾渣中一定含有銀,一定沒有鋅,可能含有銅;濾液中一定含有硝酸鋅、硝酸銅,可能含有硝酸銀;故答案為:銀(或Ag);Zn2+、Cu2+;
(2)若向所得濾液中滴加稀鹽酸,有白色沉淀生成,說明硝酸銀有剩余,結合(1)的推斷,因此利用中的溶質一定含有硝酸鋅、硝酸銅和硝酸銀;故答案為:Zn(NO3)2、Cu(NO3)2、AgNO3.
點評 本題考查了金屬的活動性順序的運用,活動性強的金屬放入活動性弱的金屬的混合鹽溶液中,活動性強的金屬會先把活動性最弱的金屬從其鹽溶液中置換出來,然后再置換活動性較弱的金屬.


 優學名師名題系列答案
優學名師名題系列答案科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
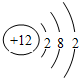
| A. | 核電荷數為12 | |
| B. | 該元素在元素周期表中處在第三周期 | |
| C. | 帶12個單位正電荷 | |
| D. | 在化學反應中,易失去最外層的2個電子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com