


 Mg+Cl2↑.沒有涉及的化學基本反應類型是化合反應和置換反應.
Mg+Cl2↑.沒有涉及的化學基本反應類型是化合反應和置換反應.

科目:初中化學 來源: 題型:解答題
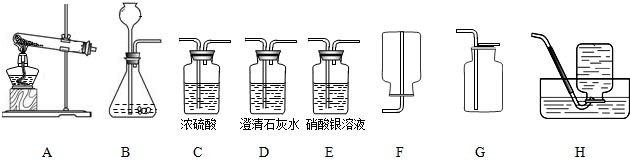
| 反應物 | ①碳酸鈣粉末+稀鹽酸 | ②碳酸鈉+稀硫酸 | ③塊狀碳酸鈣+稀鹽酸 | ④碳酸鈣+稀硫酸 |
| 現 象 | 劇烈,瞬間完成 | 劇烈,瞬間完成 | 有平穩氣流產生 | 很慢,稍后停止 |
查看答案和解析>>
科目:初中化學 來源: 題型:單選題
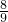 (a-b)克
(a-b)克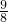 (a-b)克
(a-b)克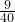 m克
m克查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:單選題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com