
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||


 贏在課堂名師課時計劃系列答案
贏在課堂名師課時計劃系列答案 天天向上課時同步訓練系列答案
天天向上課時同步訓練系列答案科目:初中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:初中化學 來源:2013年初中畢業升學考試(黑龍江大慶卷)化學(解析版) 題型:計算題
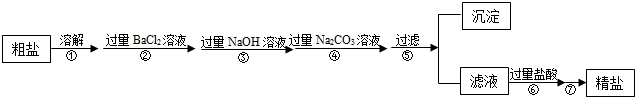
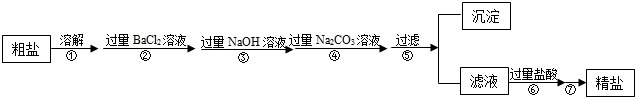
現有一定質量含有少量泥沙等不溶性雜質和少量Na2SO4,MgCl2,CaCl2等可溶性雜質的粗鹽樣品,某實驗小組利用化學實驗室常用儀器對粗鹽樣品進行提純,提純步驟如下: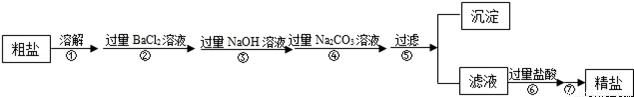
請根據提純步驟回答下列問題.
(1)步驟⑦的操作名稱為 .
(2)請寫出實驗步驟②中所涉及的化學方程式 .
(3)步驟⑥中加入過量鹽酸的目的是 .
(4)步驟②和步驟④ (填“可以”或“不可以”)顛倒,理由是 .
(5)檢驗步驟④中Na2CO3溶液已過量的方法是 .
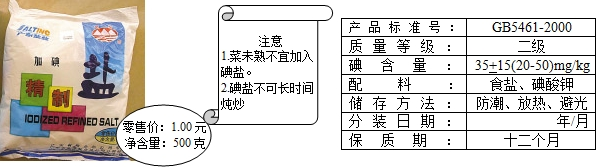
(6)加碘食鹽相關信息如圖所示.

食鹽中的碘酸鉀(KIO3)在酸性條件下,可以將碘化鉀(KI)變成碘(I2),化學方程式如下:
KIO3+5KI+6HCl=6KCI+3I2+3H2O
①向裝有碘化鉀和淀粉混合液的試管中,滴入稀鹽酸將溶液酸化,再加入食鹽,若食鹽中有碘化鉀,則加入食鹽后的實驗現象 .
②小強同學欲測定加碘鹽中碘元素的質量分數,實驗步驟如下:取10g食鹽樣品于試管中加水溶解,加入過量KI的和淀粉混合溶液,再滴入稀鹽酸將溶液酸化使其充分反應后,調節溶液呈中性,再向試管中滴加硫代硫酸鈉溶液(Na2S2O3),發生化學反應方程式為:2Na2S2O3+I2═Na2S4O6+2NaI
當加入質量分數為0.237%Na2S2O3溶液2g時,I2恰好反應完全,通過計算判斷該食鹽樣品是否合格(已知Na2S2O3的相對分子質量為158.請寫出計算過程).
查看答案和解析>>
科目:初中化學 來源:2013年初中畢業升學考試(黑龍江大慶卷)化學(解析版) 題型:計算題
現有一定質量含有少量泥沙等不溶性雜質和少量Na2SO4,MgCl2,CaCl2等可溶性雜質的粗鹽樣品,某實驗小組利用化學實驗室常用儀器對粗鹽樣品進行提純,提純步驟如下:
請根據提純步驟回答下列問題.
(1)步驟⑦的操作名稱為 .
(2)請寫出實驗步驟②中所涉及的化學方程式 .
(3)步驟⑥中加入過量鹽酸的目的是 .
(4)步驟②和步驟④ (填“可以”或“不可以”)顛倒,理由是 .
(5)檢驗步驟④中Na2CO3溶液已過量的方法是 .
(6)加碘食鹽相關信息如圖所示.
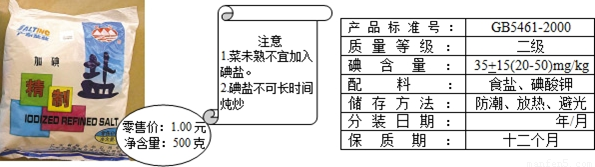
食鹽中的碘酸鉀(KIO3)在酸性條件下,可以將碘化鉀(KI)變成碘(I2),化學方程式如下:
KIO3+5KI+6HCl=6KCI+3I2+3H2O
①向裝有碘化鉀和淀粉混合液的試管中,滴入稀鹽酸將溶液酸化,再加入食鹽,若食鹽中有碘化鉀,則加入食鹽后的實驗現象 .
②小強同學欲測定加碘鹽中碘元素的質量分數,實驗步驟如下:取10g食鹽樣品于試管中加水溶解,加入過量KI的和淀粉混合溶液,再滴入稀鹽酸將溶液酸化使其充分反應后,調節溶液呈中性,再向試管中滴加硫代硫酸鈉溶液(Na2S2O3),發生化學反應方程式為:2Na2S2O3+I2═Na2S4O6+2NaI
當加入質量分數為0.237%Na2S2O3溶液2g時,I2恰好反應完全,通過計算判斷該食鹽樣品是否合格(已知Na2S2O3的相對分子質量為158.請寫出計算過程).
查看答案和解析>>
科目:初中化學 來源: 題型:解答題

查看答案和解析>>
科目:初中化學 來源: 題型:
現有一定質量含有少量泥沙等不溶性雜質和少量Na2SO4,MgCl2,CaCl2等可溶性雜質的粗鹽樣品,某實驗小組利用化學實驗室常用儀器對粗鹽樣品進行提純,提純步驟如下:
請根據提純步驟回答下列問題.
(1)步驟⑦的操作名稱為 .
(2)請寫出實驗步驟②中所涉及的化學方程式 .
(3)步驟⑥中加入過量鹽酸的目的是 .
(4)步驟②和步驟④ (填“可以”或“不可以”)顛倒,理由是 .
(5)檢驗步驟④中Na2CO3溶液已過量的方法是 .
(6)加碘食鹽相關信息如圖所示.

食鹽中的碘酸鉀(KIO3)在酸性條件下,可以將碘化鉀(KI)變成碘(I2),化學方程式如下:
KIO3+5KI+6HCl=6KCI+3I2+3H2O
①向裝有碘化鉀和淀粉混合液的試管中,滴入稀鹽酸將溶液酸化,再加入食鹽,若食鹽中有碘化鉀,則加入食鹽后的實驗現象 .
②小強同學欲測定加碘鹽中碘元素的質量分數,實驗步驟如下:取10g食鹽樣品于試管中加水溶解,加入過量KI的和淀粉混合溶液,再滴入稀鹽酸將溶液酸化使其充分反應后,調節溶液呈中性,再向試管中滴加硫代硫酸鈉溶液(Na2S2O3),發生化學反應方程式為:2Na2S2O3+I2═Na2S4O6+2NaI
當加入質量分數為0.237%Na2S2O3溶液2g時,I2恰好反應完全,通過計算判斷該食鹽樣品是否合格(已知Na2S2O3的相對分子質量為158.請寫出計算過程).
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com