
【題目】16g某純凈物跟氧氣進行充分的燃燒后,生成44g二氧化碳和36g水,請回答以下問題。
(1)參加反應的氧氣的質量是_______
(2)該物質中一定含有____________兩種元素。
(3)該物質中各元素的質量比為_______
(4)該物質最可能的化學式是_______
【答案】64g 碳、氫 3:1或1:3 CH4
【解析】
(1)根據質量守恒定律可知,參加反應的氧氣的質量是=44g+36g﹣16g=64g;
(2)參加反應的氧氣能提供氧元素,二氧化碳含有碳元素和氧元素,水中含有氫元素和氧元素,根據化學反應前后元素的種類不變,所以該物質中一定含有碳、氫兩種元素;
(3)44g二氧化碳中碳元素的質量=![]() ;36g水中氫元素的質量=
;36g水中氫元素的質量=![]() ;12g+4g=16g,該物質中只含有碳元素、氫元素,碳元素、氫元素的質量比為12g:4g=3:1。該物質中各元素的質量比為3:1或1:3;
;12g+4g=16g,該物質中只含有碳元素、氫元素,碳元素、氫元素的質量比為12g:4g=3:1。該物質中各元素的質量比為3:1或1:3;
(4)根據(3)小題的分析可知,該物質中只含有碳元素、氫元素。碳原子、氧原子的個數比=![]() ,所以該物質最可能的化學式是CH4。
,所以該物質最可能的化學式是CH4。


 名校課堂系列答案
名校課堂系列答案科目:初中化學 來源: 題型:
【題目】過氧化鎂(MgO2)是一種鎂精細化工產品。在醫療上可用來治療消化不良、胃酸過多等疾病。在環境保護方面,過氧化鎂可用來處理地下水污染的土壤。還可以用于牙膏,對牙齒有漂白和防過敏的作用。某化學興趣小組對過氧化鎂的性質和制備等進行了以下研究。
一.過氧化鎂的性質
(1)過氧化鎂(其中氧元素的化合價為____)是一種白色的粉末,其外觀與物理性質與氧化鎂相似。化學性質不夠穩定,不溶于水,但逐漸的被分解放出氧氣。
過氧化鎂有強氧化性,常溫下比較穩定,但是加熱時會分解生成氧氣和氧化鎂。請下出該反應的化學方程式________。
(2)過氧化鎂易溶于稀鹽酸,發生反應:MgO2+2HCl=MgCl2+H2O2同時溫度升高,說明該反應熱量__________(填“放出”或“吸收”)。
二.過氧化鎂的制備
下圖是利用堿式碳酸鎂(Mg2(OH)2CO3)和30%的過氧化氫溶液來制取過氧化鎂。
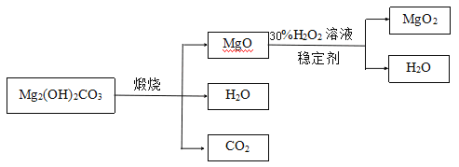
(資料)①堿式碳酸鎂與碳酸鎂有相似的化學性質,能與稀鹽酸反應產生二氧化碳②氧化鎂與過氧化氫反應放出大量的熱
(3)檢測煅燒過程堿式碳酸鎂完全分解的方法是_________(寫出具體的操作和現象);上述生產過程加入穩定的劑的作用是________。
(4)用上述堿式碳酸鎂在550、600、650及700℃下煅燒一定的時間生成氧化鎂。用上述條件制備的氧化鎂分別與30%雙氧水反應合成過氧化鎂產率(見圖1和圖2)。
堿式碳酸鎂煅燒的溫度適宜控制在________℃,煅燒的時間適宜控制在______h。
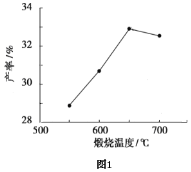
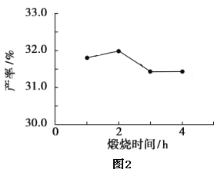
(5)結果在適宜的溫度和時間下,堿式碳酸鎂能完全分解,并且得到的氧化鎂顆粒表面積最大,能與30%過氧化氫充分反應,所以產率高。推測700℃時,產率明顯降低的可能的原因____。
三.過氧化鎂產品純度檢測
在生產過程中,過氧化鎂中常常含有少量的氧化鎂雜質(其他雜質不考慮),以下是該小組進行純度檢測的實驗裝置和實驗步驟。

①檢查裝置氣密性,裝入藥品(樣品質量為0.7g),調節刻度管使左右兩邊液面相平,刻度管度數為10.0mL。
②打開分液漏斗開關,待瓶中無氣泡產生時,關閉開關。
③再次調節刻度管使左右兩邊液面相平,刻度管度數為122mL。
(6)稀鹽酸中放入的少量硫酸銅溶液目的是__________。
(7)根據上面實驗數據計算樣品中過氧化鎂的質量分數__________(寫出具體的計算過程,實驗條件下O2密度為1.429g/L)。
(8)該小組同學所測得質量分數比實際結果偏大,你覺得可能的原因是(_______)
A 生成的氧氣有少量溶于水 B 未等裝置冷卻到室溫就開始讀數
C 雜質與鹽酸反應能產生少量的氣體 D 滴入的稀鹽酸占了一部分氣體的體積
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】碳酸鉀和碳酸鈣的固體混合物 75g 與足量的稀鹽酸充分反應后,如果將反應后的溶液蒸 干得到 82.7g 固體,則原混合物中金屬元素的質量分數為( )
A. 40%B. 44%C. 48%D. 52%
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】為除去粗鹽水中的可溶性雜質MgSO4、CaCl2,某化學小組設計了如圖方案:
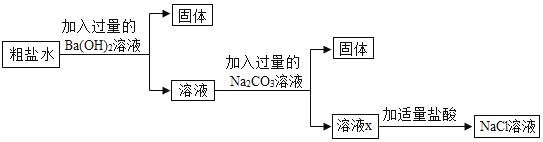
(1)加入Ba(OH)2溶液后過濾,固體的成分有_____。(寫化學式)
(2)寫出一個加入Na2CO3后發生反應的化學方程式_____。(寫一個即可)
(3)溶液X中含有哪些物質?請設計實驗證明溶液X中的雜質_____。(簡要寫出實驗步驟和現象)。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】水是生產生活中不可缺少的物質之一
(1)下列關于水的說法中錯誤的是_______
①夏天時1cm3液態水的質量小于1g②蒸餾的方法可將自來水變為純水③硬水經過吸附、過濾可變成軟水④水在自然界中不斷循環,因此水資源是取之不盡、用之不竭的⑤冰的密度比水小浮在水面上,因此水結冰時體積膨脹
(2)自制凈水器中常加入___________,用于除去水中的異味和色素。
(3)飲用硬度過大的水不利于人體健康,在生活中常用的軟化硬水的方法是_______,實驗室常用的方法是_______
(4)愛護水資源,人人有責。下列屬于“國家節水標志”的是________(填字母)。

(5)保護環境防止水體的污染是每個公民應盡的職責,下列做法中,有利于防治水體的污染是_______
①在水庫周邊興建化工廠 ②推廣使用無磷洗滌劑 ③開發生產無汞電池 ④為提高農作物產量,大量使用農藥和化肥 ⑤生活污水處理后排放
(6)“節約用水,從我做起。”請你任舉一例生活中節約用水的措施_______
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】如圖1所示,連接好裝置和壓強傳感器。氣密性良好的燒瓶內充滿CO2.分別用注射器向燒瓶中迅速注入等量的水、飽和石灰水和40%的氫氧化鈉溶液,關閉活塞,一段時間后再振蕩燒瓶。觀察傳感器所示氣壓變化如圖2所示。下列說法錯誤的是( )
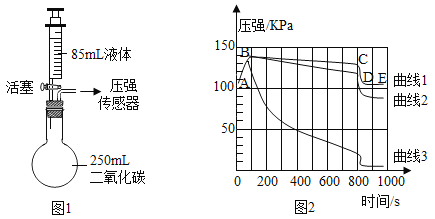
A. 曲線2代表加入的是水
B. 吸收![]() 用NaOH溶液較合適
用NaOH溶液較合適
C. AB段氣壓增大的原因之一是液體的添加使氣體體積縮小
D. 曲線1中CD段氣壓“急速”減少的原因是振蕩燒瓶使瓶內氣體迅速反應
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】純堿(Na2CO3)是一種重要的有機化工原料。侯氏制堿法制出的純堿常含少量NaCl雜質,化學興趣小組對工業純堿樣品進行實驗探究。
Ⅰ研究Na2CO3的性質
(1)Na2CO3溶液顯____(填“酸性”、“中性”或“堿性”)。
(2)檢驗樣品中碳酸根的方法是____。
Ⅱ設計以下實驗方案,測定樣品中Na2CO3的質量分數。
[方案一]取一定質量樣品,置于小燒杯中,加適量水溶解;向小燒杯中加入足量Ba(OH)2溶液,過濾,洗滌、干燥沉淀,稱量固體質量,計算。
(3)過濾操作中,除了燒杯、漏斗外,還要用到的玻璃儀器為____。
(4)實驗中判斷沉淀是否完全的方法是____。
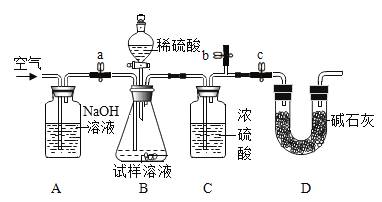
[方案二]采用如圖裝置,檢查裝置氣密性;稱取樣品m1g于錐形瓶中,稱裝置D質量為m2 g;關閉止水夾c,打開止水夾a、b,緩慢鼓入空氣數分鐘,關閉止水夾a、b,打開止水夾c,緩慢加入稀硫酸至不再產生氣體為止;打開止水夾a,緩慢鼓入空氣數分鐘,再稱量裝置D質量為m3g。
(查閱資料)濃硫酸具有吸水性,堿石灰的成分為CaO和NaOH固體
(5)裝置B中發生的化學方程式為______。
(6)樣品中Na2CO3的質量分數的計算式是______。
(7)反應后鼓入空氣的目的是______。
(8)該測定結果比實際值偏高,從裝置上分析其原因可能是______;改進措施為______。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某化學興趣小組利用下圖所示裝置進行相關實驗,請你根據下圖回答問題:
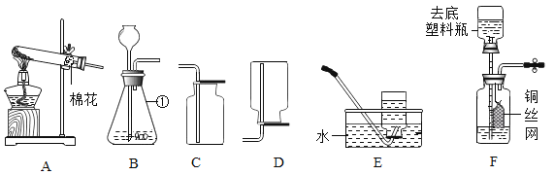
(1)寫出標有序號①的儀器名稱_______。
(2)實驗室用高錳酸鉀制取并收集較純凈的氧氣可選擇的裝置組合是_____,寫出該反應的化學方程式______。試管口放一團棉花的目的是________。某同學用收集好的氧氣做鐵絲燃燒實驗時發現集氣瓶炸裂,原因可能是______。
(3)實驗室里檢驗二氧化碳的方法是_____(用化學方程式表示)。圖F是某同學利用塑料瓶和其它用品設計的制取二氧化碳的發生裝置,該設計與B裝置比較除了廢物利用的優點外,請另寫一個優點_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】如圖為KNO3、NaNO2(亞硝酸鈉)、NaCl的溶解度曲線,下列說法正確的是
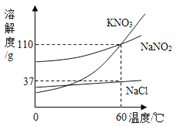
A. KNO3和NaNO2的溶解度相等
B. 60 ℃時,NaCl的飽和溶液的溶質質量分數為37%
C. 將接近飽和的NaNO2溶液變為飽和溶液,可采用降溫的方法
D. 除去NaCl中少量KNO3,可在較高溫度下制得濃溶液再冷卻結晶、過濾、干燥
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com