為了除去粗鹽配制成的NaCl溶液中所含有的少量MgCl2,CaCl2和MgSO4雜質,某同學從碳酸鈉溶液、稀鹽酸、硝酸鋇溶液、碳酸鉀溶液和氫氧化鋇溶液中選擇了A、B、C三種試劑,按以下步驟進行了實驗:
實驗Ⅰ:向溶液中加入過量A后過濾得到濾液1;
實驗Ⅱ:向濾液1中加過量B后過濾得到濾液2;
實驗Ⅲ:向濾液2中加適量C,得到較純凈的NaCl溶液.
請回答下列問題:
①A、B、C三種試劑中溶質的化學式分別為________
②實驗I中,所加A要過量的原因________
③實驗II中,所加B要過量的原因________
④實驗Ⅲ中,試劑加到________時為適量,此時得到較為純凈的NaCl溶液.
Ba(OH)
2Na
2CO
3HCl 完全除掉Mg
2+、S
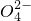
完全除掉Ca
2+、Ba
2+ 溶液中不再產生氣泡
分析:根據NaCl溶液中所含有的少量MgCl
2、CaCl
2和MgSO
4雜質,選擇除雜試劑,選擇的除雜試劑與雜質反應時要求不能生成新的雜質,選擇的除雜試劑需要含有能與鎂離子、鈣離子、以及硫酸根離子結合產生沉淀,且后加的試劑能將上一步過量的試劑反應掉.
解答:(1)要除去MgCl
2、CaCl
2和MgSO
4雜質,就是除去Mg
2+、Ca
2+和SO
42-,可以分別選用OH
-、CO
32-和Ba
2+除去,選擇的除雜試劑與雜質反應時要求不能生成新的雜質,后加的試劑能將上一步過量的試劑反應掉,可以選用的物質分別是氫氧化鋇、碳酸鈉、以及鹽酸,所以本題答案為:Ba(OH)
2,Na
2CO
3,HCl;
(2)為了充分除去Mg
2+和SO
42-,需要加入過量的氫氧化鋇,氫氧化鋇能與氯化鎂反應生成氫氧化鎂沉淀和氯化鋇,硫酸鎂能與氫氧化鋇反應生活硫酸鋇沉淀和氫氧化鎂沉淀,所以本題答案為:為了除盡MgCl
2、MgSO
4;
(3)為了除去Ca
2+和上一步過量的鋇離子,需要加入過量的碳酸鈉,碳酸鈉能與氫氧化鋇反應生成碳酸鋇沉淀和氫氧化鈉,能與氯化鈣反應生成碳酸鈣沉淀和氯化鈉,能與氯化鋇反應生成碳酸鋇沉淀和氯化鈉,所以本題答案為:為了除盡Ba(OH)
2、CaCl
2、BaCl
2;
(4)經過實驗Ⅰ和實驗Ⅱ,食鹽中還含有的雜質是氫氧化鈉和碳酸鈉,此時可以加入鹽酸將多余的氫氧化鈉和碳酸鈉除掉,碳酸鈉能與鹽酸反應生成二氧化碳氣體,當完全反應時無氣泡產生,所以本題答案為:剛好無氣體放出.
故答案為:(1)Ba(OH)
2、Na
2CO
3、HCl
(2)為了除盡MgCl
2、MgSO
4 (或答:為了除盡 Mg
2+、SO
42-)
(3)為了除盡Ba(OH)
2、CaCl
2、BaCl
2(或答:為了除盡Ba
2+、Ca
2+)
(4)剛好無氣體放出時(或答:用酚酞檢驗,紅色剛剛褪去時)
點評:本題考查了物質的除雜,完成此題,要求選擇的除雜試劑與雜質反應時要求不能生成新的雜質,且后加的試劑能將上一步過量的試劑反應掉.

 完全除掉Ca2+、Ba2+ 溶液中不再產生氣泡
完全除掉Ca2+、Ba2+ 溶液中不再產生氣泡

 閱讀快車系列答案
閱讀快車系列答案