將5g碳放在盛有8g氧氣的密閉容器中燃燒,反應結束后,容器中碳和氧氣沒有剩余,則容器中的氣體是 ,質量是 .
【答案】
分析:根據碳與氧氣的反應可知,若氧氣足量生成二氧化碳,若氧氣不足則生成一氧化碳,利用化學反應及極限假設來計算判斷反應的生成物.
解答:解:設完全燃燒需要的氧氣的質量為x,
C+O
2
CO
2 12 32
5g x
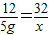
解得x=13.3g,
即若完全燃燒生成二氧化碳時氧氣不足;
設不完全燃燒生成一氧化碳需要的氧氣的質量為y,
由2C+O
2
2CO,
24 32
5g y
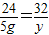
解得y=6.67g,
即若不完全燃燒生成一氧化碳時氧氣過量;
則兩個反應都發生,即充分反應后,密閉容器中的氣體物質既有一氧化碳也有二氧化碳;根據質量守恒定律可知,一氧化碳和二氧化碳質量是5g+8g=13g.
故答案為:一氧化碳和二氧化碳;13g.
點評:本題考查碳與氧氣的反應產物的推斷,明確發生的化學反應,利用極限假設法來計算是解答的關鍵.

 CO2
CO2
 2CO,
2CO,