解:(1)金屬都具有良好的導熱性、導電性及延展性;
(2)A.將鐵片放入鹽酸中,可說明鐵在金屬活動順序中位于氫之前;B.將銅片放入鹽酸中,可說明銅在金屬活動順序中位于氫之后;C.將鐵片放入硝酸銀溶液中,可說明鐵的活動性比銀強;D.將銅片放入硝酸銀溶液中,可說明銅的活動性比銀強;因此,要證明鐵、銅和銀的活動性順序,需要進行ABD三個實驗;
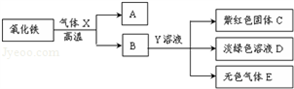
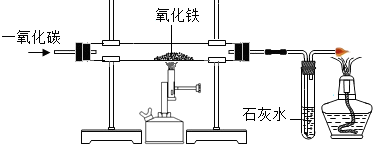
(3)根據氧化鐵在高溫下能與還原性氣體一氧化碳或氫氣反應生成鐵,可判斷氣體X為一氧化碳或氫氣;根據鐵與可溶性銅鹽、酸發生置換反應,結合框圖關系,物質B能與溶液Y反應得到紫紅色C固體銅、淺綠色的亞鐵鹽溶液及無色氣體E,可推斷物質B為還原后所得到的鐵,而溶液Y為硫酸銅(或氯化銅)與酸(硫酸或鹽酸)的混合溶液,氣體E為氫氣,則氣體X為一氧化碳;因此①氣體X與氧化鐵反應的化學方程式3CO+Fe
2O
3
2Fe+3CO
2,②Y溶液中的溶質為CuSO
4(或CuCl
2)和H
2SO
4(或HCl),
③生成無色氣體E的化學方程式為Fe+H
2SO
4═FeSO
4+H
2↑(或Fe+2HCl═FeCl
2+H
2↑);
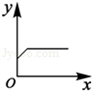
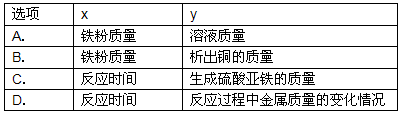
(4)A、隨著鐵粉質量增加,反應得到硫酸亞鐵質量小于原硫酸銅溶液質量,因此溶液質量會逐漸減小至完全反應而不變;與曲線所示不符;
B、隨著鐵粉質量增加,析出銅粉的質量應從0開始增加,與曲線所示不符;
C、隨反應時間延長,生成硫酸亞鐵質量也應從0開始增加,與曲線所示不符;
D、由于等質量鐵所置換出銅的質量大于所消耗鐵粉質量,因此,隨反應時間延長,固體質量逐漸增加至完全反應不再改變;與曲線所示相符;
故答案為:
(1)導熱性(或導電性、延展性等);
(2)ABD;
(3)①3CO+Fe
2O
3
2Fe+3CO
2;
②CuSO
4(或CuCl
2)和H
2SO
4(或HCl);
③Fe+H
2SO
4═FeSO
4+H
2↑(或Fe+2HCl═FeCl
2+H
2↑);
(4)D.
分析:(1)根據金屬物理性質的共同,對三種金屬物理相似處進行回答;
(2)根據三種金屬的活動性強弱關系,分析所設計實驗對檢驗活動性的作用,判斷可以檢驗三種金屬活動性順序的實驗組合;
(3)利用物質或溶液的顏色及關系框圖,推斷所涉及的物質,寫出所涉及反應的化學方程式及判斷溶液中可能的溶質;
(4)圖示的曲線表明,隨著x的增加y的質量開始增大,至一定量時不再改變.
點評:在分析表示變化的曲線時,曲線的起點、折點及趨勢的特殊意義是我們分析時必需重點關注的對象.



 2Fe+3CO2,②Y溶液中的溶質為CuSO4(或CuCl2)和H2SO4(或HCl),
2Fe+3CO2,②Y溶液中的溶質為CuSO4(或CuCl2)和H2SO4(或HCl), 2Fe+3CO2;
2Fe+3CO2;

 閱讀快車系列答案
閱讀快車系列答案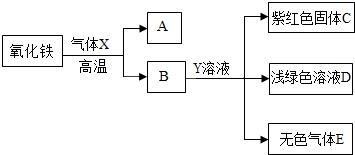
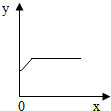
 鐵、鋁、銅是日常生活中使用最廣泛的金屬.
鐵、鋁、銅是日常生活中使用最廣泛的金屬.