B
分析:氫氧化鈉溶液顯堿性,堿性溶液的pH大于7;向NaOH溶液中不斷滴加鹽酸溶液時,鹽酸與氫氧化鈉發生中和反應生成氯化鈉和水,氯化鈉溶液呈中性,中性溶液的pH等于7;由于氫氧化鈉減少,所以溶液的pH不斷減小,當鹽酸與氫氧化鈉恰好完全發生時,溶液呈中性,溶液的pH等于7;再滴加稀鹽酸,溶液顯酸性,溶液的pH小于7.
解答:
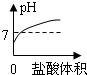
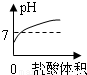
A、由于氫氧化鈉溶液顯堿性,堿性溶液的pH大于7,所以圖象上的起點不應在7下方,故A錯誤;
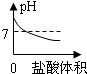
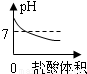
B、氫氧化鈉溶液顯堿性,堿性溶液的pH大于7;向NaOH溶液中不斷滴加鹽酸溶液時,鹽酸與氫氧化鈉發生中和反應生成氯化鈉和水,氯化鈉溶液呈中性,中性溶液的pH等于7;
由于氫氧化鈉減少,所以溶液的pH不斷減小,當鹽酸與氫氧化鈉恰好完全發生時,溶液呈中性,溶液的pH等于7;再滴加稀鹽酸,溶液顯酸性,溶液的pH小于7;故B正確
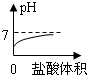
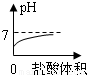
C、由于氫氧化鈉溶液顯堿性,堿性溶液的pH大于7,所以圖象上的起點不應在7下方,而且因為最終加入的鹽酸過量時,溶液顯酸性,所以終點應在7的下方,故C錯誤;
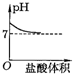
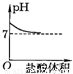
D、因為當最終加入的鹽酸過量時,溶液顯酸性,所以終點應在7的下方,故D錯誤;
故選B
點評:這是一道函數圖象的考題,重點考查了酸和堿的pH以及酸堿中和的問題,是考試的重點.